摘 要:汉麻(Cannabis sativa L.)是一种历史悠久的药用植物和经济作物,其应用涉及医药、食品、化妆品等多个领域.大麻素是汉麻的主要活性成分,根据结构特点可分为 11 种类型,主要包括 Δ9-四氢大麻酚(Δ9-THC)、大麻二酚(CBD)、大麻环萜酚(CBC)、大麻萜酚(CBG)等.大麻素合成途径主要由 3 个步骤构成:聚酮合成、MEP 途径和氧化环化,这些过程受到诸多酶的调控,如 THCA 合成酶(THCAS)、CBDA 合成酶(CBDAS)、CBCA 合成酶(CBCAS)、 CBGA 合成酶(CBGAS)、橄榄酸环化酶(OAC)、橄榄醇合酶(OLS)、酰基活化酶(AAE)等.就汉麻中几种主要的大麻素类成分、功能、生物合成途径、编码生物合成途径各关键酶基因方面的研究进展进行综述,以期对加快我国大麻素的相关研究及培育新的汉麻品种提供参考。
关键词:汉麻;大麻素;生物合成途径;基因
汉麻(Cannabis sativa L.)为大麻科大麻属,雌雄异株,双子叶一年生草本植物[1],具有悠久的应用历史,其药用最早出现在《神农本草经》中.除药用外,也用于纺织、造纸、榨油等领域.其茎早在上千年前就开始被用来生产纤维,其果实被中医称为“人仁”,含有 90 多种不饱和脂肪酸,具有药食两用的作用[2].汉麻中含有多种天然化合物,目前已从汉麻中分离鉴定出超 500 种化学成分,如大麻素、酚萜类、黄酮类、甾体类、脂肪酸、生物碱等,其中包含 150 多种大麻素类物质,60 多种大麻酚类物质.
植物大麻素首先从汉麻中分离得到,是汉麻中的主要活性物质,也是特有的一类萜烯化合物[3].大麻素因能够减轻某些疾病的症状,如癫痫、慢性疼痛、炎症等而备受关注,被广泛应用在食品、药品、医疗行业.近年来,随着内源性大麻素系统(Endocannabinoid system,ECS)以及在人体中 I 型大麻素受体(Cannabinoid receptor 1,CB1)和 II 型大麻素受体(Cannabinoid receptor 2,CB2)的发现,加速了对大麻素的研究[4]。
1 汉麻主要大麻素类成分研究进展
大麻素类化合物具有典型的 C21 萜酚骨架.主要分成有 11 种类型,包括 Δ9-四氢大麻酚(Δ9-tetrahydrocannabinols,Δ9-THC)、大麻二酚(cannabidiols,CBD)、大麻环萜酚(cannabichromenes, CBC)、大麻萜酚(cannabigerols,CBG)、大麻酚(cannabinols,CBN)、Δ8-四氢大麻酚(Δ8-tetrahydrocannabinols, Δ8-THC)、大麻环酚(cannabicyclols,CBL)、大麻艾尔松(cannabielsoins,CBE)、脱氢大麻二酚(cannabinodiols,CBND)、二羟基大麻酚(cannabitriols,CBT)以及其他类型[5].其中,Δ9-THC,CBD,CBC 的含量占酚类物质总量的 90%以上,其他大麻素则被称为次要大麻素或稀有大麻素.
1.1 Δ9-THC
Δ9-THC 是汉麻中的主要药理活性成分之一,可产生多种精神活性作用.研究发现,Δ9-THC 对中枢神经系统有一定的影响,使用后可产生欣快感,具有致幻、兴奋和成瘾性.依据现行法规与标准,将大麻在开花期雌株顶部叶片及花穗中 Δ9-THC 干质量含量超过 0.3%的称为药用或毒品大麻,并因此受到管制[6]. 1964 年,Gaoni[7]等首次报道了Δ9-THC 的结构.2005 年,Δ9-THC 首次在加拿大获得药物许可,用于缓解多发性硬化症或晚期癌症所引发的疼痛,以及改善多发性硬化症引起的痉挛[8].2023 年,有研究者在一篇文章中提到四氢大麻酚酸(Δ9-tetrahydrocannabinolic acid,THCA)与大麻二酚酸(cannabidiolic acid,CBDA)联合使用可以减轻阿尔兹海默病症状[9].
1.2 CBD
CBD 可通过对活性氧、内质网应激和免疫的调节作用抑制癌细胞增殖和转移,促进癌细胞凋亡,在难治性癫痫、抑郁症、内分泌代谢相关疾病以及癌症等方面极具利用潜力,被广泛应用在临床治疗中[10].1940 年,CBD 被成功分离.1963 年,Mechoulam[11]等测定了 CBD 的化学结构.1990 年,内源性大麻素系统被发现,人体各个组织部位均含有 CB1 和 CB2 受体,Δ9-THC 对 CB1 和 CB2 亲和力高,CBD 亲和力较低,因此 CBD 不具精神活性,且因为在人体中能模仿内源性大麻素,逐渐被应用到食品、化妆品、药品中[12-13].2019年,Citti[14]等首次报道了 CBD 和 Δ9-THC 的同系物,将其命名为反式大麻二酚(CBDP)(Cannabidiphorol)和反式四氢大麻酚(Δ9-THCP)(Δ9-tetrahydrocannabiphorol),其中,CBDP 与 CBD 功效相似,Δ9-THCP 缓解疼痛的效果是 Δ9-THC 的 30 倍左右.2020 年,Martinenghi[15]等发现 CBD 对革兰氏阳性菌表现出很强的抗菌作用,可以用作治疗金黄色葡萄球菌(Staphylococcus aureus,MRSA)引发的一系列疾病.
1.3 CBC
CBC 具有抗炎、抗真菌活性,主要集中在汉麻幼苗时期生成,含量随着植物成熟而下降.1966 年, Gaoni 等发现了 CBC 的结构[16].1968 年,Shoyama[17]等分离出了 CBC 的化学成分.2023 年,GOJANI[18]等使用体外系统研究了 CBC 和 CBN 的抗炎机制,发现 CBC 可通过抑制 P-NF-κB(核因子 NF-κB 磷酸化形式)下调促炎基因转录,发挥抗炎作用.
1.4 次要大麻素
除上述描述的大麻素外,还有一些相关研究较少的次要大麻素.(1)CBG.1964 年,CBG 类化合物第一次被报道,其对革兰氏阳性菌有很大的抗菌活性,目前共发现 16 个 CBG 类化合物[19].(2)CBN.1896 年,Wood 等在汉麻中发现了 CBN,其具有镇静助眠、缓解疼痛和刺激骨骼生长等作用,目前在汉麻中发现 10 个 CBN 类化合物.(3)Δ8-THC.1966 年,Δ8-THC 被首次分离,目前共发现 5 个 Δ8-THC 类化合物.(4)CBL.1972 年,Shoyama 等从汉麻中提取到 CBL,其具有独特的四环结构[20].
汉麻是目前研究中最常见且最多产的植物大麻素来源,但不是唯一能够合成这些生物活性天然产物的生物体.有研究在杜鹃属植物中检测到了 CBC;在蜡菊、紫穗槐中检测到具有大麻素主链的化合物;在苔藓中也检测到了大麻素类化合物[21].
2 大麻素生物合成途径
尽管汉麻种植历史已有数千年,但大麻素生物合成途径直到近几年才逐渐明晰[22].汉麻分泌型腺毛是大麻素的主要合成与储存部位,雌株中腺毛的单位数量通常较雄株多,尤其在花和幼叶等部位腺毛分布更为密集.分泌型腺毛又被分为头状有柄腺毛、头状无柄腺毛以及球状腺毛[23]12.有柄腺毛的分泌能力最强,且分泌的大麻素种类最为丰富[24].
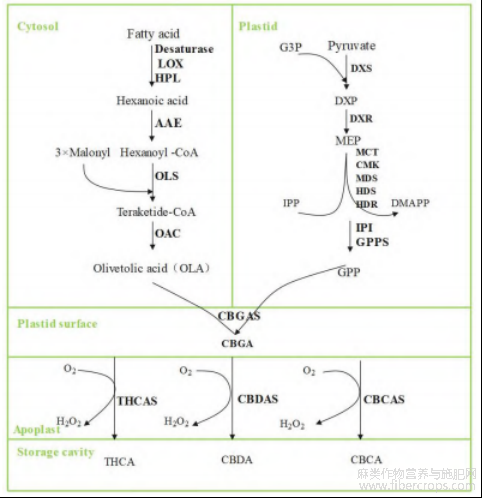
THCA、CBDA、大麻环萜酚酸(cannabichromenic acid,CBCA)是生物合成途径的终产物,大麻素的合成途径主要分为 3 个步骤:聚酮合成、MEP 途径、氧化环化[25].
2.1 聚酮合成
聚酮合成发生在细胞质溶胶内,前体分子己酸(Hexanoic acid)可能通过脂肪酸(Fatty acid),经去饱和酶(Desaturase)、脂氧合酶(Lipoxygenase,LOX)、过氧化氢裂解酶(Hydrogen peroxide lyase,HPL)的氧化裂解而获得,该反应在植物中广泛存在[26]12811.
己酸合成后在酰基活化酶(Acyl-activating enzyme,AAE)的作用下生成己酰辅酶 A(Hexanoyl-CoA).橄榄醇合酶(Olivetol synthase,OLS)催化乙酰辅酶 A 与三分子的丙二酰辅酶 A(Malonyl)缩合,形成线性中间体四酮辅酶 A(Teraketide-CoA).橄榄酸环化酶(Olivetolic acid cyclase,OAC)对线性四酮中间体进行 C2→C7 醛醇缩合,进一步环化产生主要产物橄榄酸(Olivetolic acid,OLA)[27].
2.2 MEP 途径
焦磷酸香叶酯(Geranyl diphosphate,GPP)源自甲基赤藓糖醇 4-磷酸(2-C-Methyl-D-erythritol-4- phosphate,MEP)途径,该途径为植物进行萜类物质合成的重要步骤,其通常在真核细胞的质体(通常为叶绿体)中发生[28].首先丙酮酸(Pyruvate,Pyr)和甘油醛-3-磷酸(Glyceraldehyde 3-phosphate,G3P)缩合形成 1-脱氧木酮糖-5-磷酸(1-deoxy-D-xylulose-5-phosphate,DXP),DXP 在脱氧木酮糖磷酸还原异构酶(1-deoxy-D-xylulose-5-phosphate reductoisomerase,DXR)的作用下生成 MEP,随后 MEP 被 2-C-甲基-D-赤藓糖醇-4-磷酸胞苷转移酶(2-C-Methyl-D-erythritol-4-phosphate cytidyltransferase,MCT)、4二磷酸-2-C-甲基-D-赤藓糖醇激酶(4-diphosphocytidyl-2-C-methyl-D-erythritol kinase,CMK)、1-羟基-2-甲基-2-(E)-丁烯基-4-焦磷酸还原酶(1- hydroxy-2-methyl-2-(E)-butenyl-4-diphosphate reductase,HDR)等连续多个酶催化,合成产物异戊烯基二磷酸(Isopentenyl diphosphate,IPP)和二甲基烯丙基二磷酸(Dimethylallyl diphosphate,DMAPP)[29].IPP 和 DMAPP 通过异戊烯基二磷酸异构酶(Isopentenyl diphosphate isomerase,IPI)进行转换,在焦磷酸香叶酯合成酶(Geranyl diphosphate synthase,GPPS)作用下缩合生成一种类异戊二烯化合物 GPP,为大麻素提供合成所需的单萜部分,GPP 生物合成发生在质体基质中,可以在疏水膜内自由移动.
此外,在质膜上,GPP 和 OLA 经由质体膜定位的芳香族异戊二烯基转移酶(Aromatic prenyltransferase, aPT,又称为大麻酚萜酸合成酶 CBGAS)催化生成大麻萜酚酸(Cannabigerol acid,CBGA),该大麻素也是末端大麻素的共同底物[30].
2.3 氧化环化
大麻素生物合成的最后一步发生在细胞外储存腔中的细胞壁表面上[31].CBGA 作为前体,在四氢大麻酚酸合成酶(THCA synthase,THCAS)、大麻二酚酸合成酶(CBDA synthase,CBDAS)和大麻环萜酚酸合成酶(CBCA synthase,CBCAS)催化作用下,氧化环化为 THCA,CBDA,CBCA[32].
末端大麻素目前认为是以 2 种化学形式存在:脱羧形式、羧化形式.在新鲜的汉麻组织中,羧化形式是主要形式(即 THCA,CBDA,CBCA,CBGA),该形式大麻素可通过一系列非酶促脱羧反应过程(如干燥、加热或焚烧等)转化为脱羧形式,即 THC,CBD,CBC,CBG 等.其他大麻素可以通过 THC,CBD,CBC异构化来合成,并且大麻素之间的转化也可以在特定条件下发生并且大麻素之间的转化也可以在特定条件下发生(见图1)。
图1 大麻素合成途径
注:CytosolCytosol为聚酮合成;Plastid为MEP途径;Apoplast为氧化环化.
3 大麻素生物合成途径相关基因研究进展
随着测序技术的进步,汉麻的基因组已经公布了多个版本,促进了研究者在基因水平上更深入地理解大麻素的合成机制.陈璇[33]等对汉麻不同发育时期主要大麻素含量变化以及大麻素合成途径中 16 个关键酶基因的表达水平进行了测定,发现 OLS,aPT,THCAS3 个酶基因在始果期苞片腺毛中影响大麻素的合成积累.Prentout[34]等在汉麻中鉴定了至少 500 个性连锁基因,并在可参考的基因组中鉴定了汉麻的性染色体.大量研究表明,参与大麻素生物合成途径的基因在汉麻中表达量更高,且大麻素生物合成基因的正向转录调控在汉麻中更为活跃.
3.1 四氢大麻酚酸合成酶基因(THCAS)
1995 年,Taura[35]等在汉麻中发现了 THCAS,该酶结构域与氧化还原酶小檗碱桥酶家族(BBE)具有高度同源性,在腺毛腔中发挥作用.有研究者成功克隆了 THCAS 基因,该基因由 1 638 bp 无内含子的开放阅读框构成,编码 545 个氨基酸组成的多肽,其中 N 端 28 个氨基酸构成信号肽[36].Zirpel[37]等在酿酒酵母和毕赤酵母中成功表达了 THCAS.姜颖[38]等通过 RNA 干扰 CsTHCAS 并转化汉麻茎尖,发现在转基因植株中,CsTHCAS 表达量和 THC 含量均显著降低,证明 THC 的含量受到 CsTHCAS 的正调控.LIU[39]等克隆了 CsTHCAS 启动子,并利用酵母单杂交筛选出了 3 个转录因子(CsAP2L1,CsWRKY1,CsMYB1),证实其中 CsAP2L1 正调控 THCAS,而 CsWRKY1,CsMYB1 负调控 THCAS.Matchett-Oates[40]等构建了 THCAS,CBDAS,CBCAS 对应的基因序列的 RNAi 载体,使用实时定量 PCR 发现所有大麻素生物合成基因均显著下调.
3.2 大麻二酚酸合成酶基因(CBDAS)
CBDAS 是合成 CBDA 的关键酶基因.1996 年,Taura 等在汉麻中克隆了编码 CBDAS 的基因,该基因的开放阅读框长度为 1 635 bp,无内含子,编码 544 个氨基酸残基组成的多肽,其中 N 端 28 个氨基酸构成信号肽[26]12811.潘根[41]等对 CBDAS 基因家族进行全基因组鉴定,结果显示,该基因家族 5 个成员的启动子区均富含光响应元件.蔡晓雪[42]等通过实验证明 CBDAS 能在烟草中催化 CBGA 产生 CBDA.
CBDAS 与 THCAS 由 1 个共显性基因 B 位点控制,两者互为同分异构体.CBDAS 与 THCAS 肽链一级结构的相似性高达 83.9%[23]12.2018 年,Zirpel[43]等在毕赤酵母中重组表达了 THCAS,CBDAS 基因,并转化前体 CBGA,检测到 8 种不同的产物,分别是 THCA,CBDA,CBCA 和 5 种仍待确定的副产物.Deguchi[44] 等构建了 CBDAS 基因过表达和 THCAS 基因沉默的双元载体.与对照相比,CBDAS 基因的转录水平提高了 10 倍以上,CBD 总含量增加了 54%,THCAS 基因沉默下调了 THCAS 基因的表达,转录水平下降了 80%,总 THC 含量下降了 43%.Aryal[45]等发现 THCAS 和 CBDAS 基因不仅在汉麻中出现,而是在植物界中广泛分布.
3.3 大麻环萜酚酸合成酶基因(CBCAS)
1998 年,CBCAS 被研究者发现,Laverty[46]等证明,编码 71 kDa CBCAS 的纤维型 THCAS 基因能够将 CBGA 前体转化为 CBCA,证实了该基因能在酵母菌中表达 CBCA 的活性,并且 CBCA 的积累与各种大麻组织中 CBCAS 的转录水平相关,在雌性花组织中观察到的水平最高.有研究表明,CBCAS 与 THCAS 在氨基酸水平上具有 92%的同源性,且 CBCAS 基因包括一个 1 638 bp 无内含子的开放阅读框[47].
3.4 大麻萜酚酸合成酶基因(CBGAS)
1998 年,Fellermeier[48]等发现汉麻中催化 CBGA 合成的酶 CBGAS 是 aPT.2009 年,Saleh[49]等证明该酶是 Mg2+依赖性膜结合酶,参与许多特殊代谢物的合成,目前已知的植物 aPT 酶都属于 UbiA 蛋白超家族.LUO[50]等成功用来自链霉菌属菌株的可溶性异戊烯基转移酶 NphB 替代汉麻 CBGAS 合成 CBGA,另外,将新发现的汉麻香叶基转移酶(CsaPT4)基因转入含 GPP 和 OLA 的菌株中,成功合成了 136 mg/L 的 CBGA,NphB 和 CsaPT4 的发现及应用为异源大麻素生物合成和调控植物中大麻素类成分的含量奠定了基础.Gülck[51]等分析了雌性汉麻的 30 种不同转录组,发现 12 个 aPT 单基因(CsaPT1-12),其中 CsaPT 1, CsaPT 4 表达量最高,定位于叶绿体,其次是 CsaPT 3,CsaPT 7,CsaPT 10 在腺毛中表达量中等,CsaPT 2,CsaPT 5,CsaPT 6,CsaPT 8,CsaPT 9,CsaPT 11,CsaPT 12 在腺毛中表达量低,并证明了 CsaPT4 在本氏烟草中具有 CBGAS 活性.Sands[52]等提到 CsaPT1,CsaPT4 可能参与不同的生物合成途径.同年,Kearsey[53] 等首次实现在优化的微生物系统下,使用 aPT 在大肠杆菌细胞中合成 CBG,该研究为在大肠杆菌中可持续生产经过充分研究的稀有大麻素奠定了基础.
3.5 橄榄酸环化酶基因(OAC)
Gagne[54]等通过转录组实验在雌性汉麻的腺毛中发现了 OAC,该酶属于二聚体 α+β 桶(DABB)蛋白家族,为植物聚酮环化酶.YANG[55]等分析了 OAC 的结构,并提出了 OAC 的催化机理,其催化功能是形成环化产物,且 OAC 采用酸/碱催化化学,在 Tyr72 和 His78 的存在下,形成 OLA 的前体.LUO[50]等将 CsOAC,CsOLS 体外转化到酵母菌株中,使 OLA 产量增加了 6 倍.
3.6 橄榄醇合酶基因(OLS)
2009 年,Taura[56]等首次在汉麻中鉴定出新的Ⅲ型聚酮合成酶(Polyketide synthase,PKS),并将其命名为橄榄醇合成酶(Olivetol synthase,OLS).III 型 PKS 是一类同源二聚体蛋白,在植物中广泛存在.同年,该团队成功克隆了 OLS 的编码基因,该基因的开放阅读框为 1 155 bp,编码的多肽由 385 个氨基酸残基组成.MA[57]等将 OLS,OAC 基因进行密码子优化后转入解脂耶氏酵母(Yarrowia. lipolytica)中,构建了 OLA 合成菌株,该菌株在培养 96 h 后产生了 0.11 mg/L OLA.朱雪雯[58]等对汉麻 PKS 基因家族进行了全基因组层面研究,明确了该家族各基因在汉麻组织的表达特异性,为揭示 CsPKS 基因功能提供了理论支持.
3.7 酰基活化酶基因(AAE)
AAE 负责催化合成 OLA 的前体己酰辅酶 A,该超家族通过腺苷酸中间体激活羧酸而发挥作用,编码 AAE 的基因在汉麻雌花中表达量最高.Stout[59]等分析了汉麻腺毛的转录组,推测了 11 个编码 AAE 的单基因,其中 CsAAE1 在腺毛中高表达,且亚细胞定位实验证明该基因在细胞质中发挥作用.CsAAE3 是一种过氧化物酶体靶向酶,可能参与 β 氧化,可激活多种脂肪酸底物,包括己酸酯.AAE 是大麻素合成途径中重要的前体催化酶,研究该基因有助于理解大麻素的生物合成途径,但目前关于该基因的研究还相对较少.
3.8 其他酶基因进展
除上述大麻素合成途径中被广泛研究的酶基因外,还有一些目前尚未深入研究的酶基因.(1)DXR 基因.1998 年,DXR 基因首次从大肠杆菌中分离[60].(2)GPPS 基因.Chuang[61]等证明 GPPS 基因过表达或上调会增加大麻素合成前体单萜的含量.此外,Borrego[62]等鉴定了 21 个 LOX、5 个环氧丙烷合酶(Allene oxide synthase,AOS)、3 个环氧丙烷环化酶(Allene oxide cyclase,AOC)、1 个 HPL、5 个 12-氧植物二烯酸还原酶(12-oxo-phytodienoic acid reductase,OPR),这些酶负责大麻素的前体合成.
4 结语
汉麻作为重要的经济作物,由于含有致瘾性化合物 THC,许多国家已经限制或禁止种植.然而,汉麻中多种大麻素的显著药用价值使得对汉麻种植的需求增加.一些生物合成途径关键酶基因参与了大麻素的诸多生物过程,是大麻素合成调节的重要成员.近年来,关于大麻素类化合物(如 THC,CBD)生物合成过程中部分关键酶基因的研究已取得一定进展.这些研究成果为后续异源生物合成,优化培养条件以提高理想大麻素产量,以及降低副产物积累等方面奠定了基础.
但汉麻腺毛发育和大麻素合成途径仍需继续深入研究,如 MEP 途径中,DXR,DXS,HDR,HDS, MCT,MDS,aPT 等酶基因是如何参与前体物质合成的还尚不明朗.此外,WANG[63]等发现汉麻 CsMATEs 可能参与大麻素的生物合成,可用于大麻素的异源生产.发现并探索这些新基因将为今后揭示大麻素的生物合成途径提供新的线索,以及在合适的异源宿主中实现大麻素的大量异源生产提供了可能.
目前,汉麻的遗传转化体系尚不成熟,虽已有文献报道了汉麻遗传转化和再生的方法,但再生效率低,且缺乏稳定性.因此,这一领域的研究至今仍具有一定挑战.建立高效稳定且完整的汉麻遗传转化体系,对汉麻生物合成调控及分子生物学的研究都具有至关重要的作用,因此仍需进一步探索.
大麻素具有抗炎、止痛、抗焦虑等多种药理作用,对癫痫、肿瘤等疾病均有治疗效果.因此,开发大麻素相关药物,为治疗和缓解各种疾病提供新的方案,也将成为研究大麻素的新思路.除医药领域外,大麻素由于具有保湿、抗氧化、抗炎等功效,在保健食品和化妆品领域的潜在应用也值得关注.
在各种生物合成途径中,转录因子或转录调控网络的关键作用不可或缺,所以由转录因子构成的调控网络模块的研究也尤为重要.目前,对大麻素的研究主要是基因分离及功能鉴定等,随着测序技术的进步,汉麻不同组织的转录组、基因组、蛋白质组、代谢组学等将会为筛选与大麻素合成途径中调控的候选转录因子提供重要的遗传资源,进而从分子生物学角度进一步研究大麻素的合成途径,筛选影响大麻素生物合成的这些转录因子以及进一步确定其调控网络,研究彼此之间的互作协调机制,挖掘这些转录因子发挥功能的机制,将成为以后研究汉麻的新思路.
参考文献
[1] Bonini S A,Premoli M,Tambaro S,et al.Cannabis sativa:A comprehensive ethnopharmacological review of a medicinal plant with a long history[J].Journal of Ethnopharmacology,2018,227:300-315.
[2] Kim P S,Fishman M A.Cannabis for pain and headaches:primer[J].Curr Pain Headache Rep,2017,21(4):19.
[3] Pugazhendhi A,Suganthy N,Chau T P,et al.Cannabinoids as anticancer and neuroprotective drugs:structural insights and pharmacological interactions-A review[J].Process Biochemistry,2021,111:9-31.
[4] 王欣,康淑荷,魏亚军,等.内源性大麻素系统及其在癌症中的作用机制研究进展[J].沈阳药科大学学报,2023,40(6):807-817,842.
[5] Almeida C F,Teixeira N,Correia-da-Silva G,et al.Cannabinoids in breast cancer:differential susceptibility according to subtype[J].Molecules,2022,27(1):156.
[6] 孔剑梅,沈琰.工业大麻花叶提取大麻二酚工艺技术综述[J].云南化工,2019,46(8):1-4.
[7] Gaoni Y,Mechoulam R.Isolation,structure and partial synthesis of an active constituent of hashish[J].J Am Chem Soc,1964, 86:1646-1647.
[8] Pertwee R G.Emerging strategies for exploiting cannabinoid receptor agonists as medicines. Br[J].J Pharmacol,2009,156, 397-411.
[9] Kim J,Choi P,Park Y T,et al.The Cannabinoids,CBDA and THCA,Rescue Memory Deficits and Reduce Amyloid-Beta and Tau Pathology in an Alzheimer's Disease-like Mouse Model[J].Int J Mol Sci,2023,24(7):6827.
[10]徐晖,陆征杰,李翼,等.工业大麻中非兴奋剂成分大麻二酚检测方法的研究进展[J].理化检验(化学分册),2023,59(3):367-372.
[11]Mechoulam R,Shvo Y.Hashish I.The structure of cannabidiol[J].Tetrahedron,1963,19(12):2073-2078.
[12]Pertwee R G.The diverse CB1 and CB2 receptor pharmacology of three plant cannabinoids:Δ9-tetrahydrocannabinol,cannabidiol,and Δ9-tetrahydrocannabivarin[J].British Journal of Pharmacology and Chemotherapy,2008,153(2):199-215.
[13]Thomas A,Baillie G L,Phillips A M,et al.Cannabidiol displays unexpectedly high potency as an antagonist of CB1 and CB2 receptor agonists in vitro[J].British Journal of Pharmacology,2007,150(5):613-623.
[14]Citti C,Linciano P,Forni F,et al.Analysis of impurities of cannabidiol from hemp.Isolation,characterization and synthesis of cannabidibutol,the novel cannabidiol butyl analog[J].J Pharm Biomed Anal,2019,175:112752.
[15]Martinenghi L D,Jonsson R,Lund T,et al.Isolation,Purification,and Antimicrobial Characterization of Cannabidiolic Acid and Cannabidiol from Cannabis sativa L[J].Biomolecules,2020,10(6):900.
[16]Mechoulam R,Gaoni Y.Recent advances in the chemistry of hashish[J].Fortschr Chem Org Naturst,1967,25:175- 213.
[17]Shoyama Y,Fujita T,Yamauchi T,et al.Cannabichromenic acid,a genuine substance of cannabichromene[J].Chem Pharm Bull(Tokyo),1968,6(6):1157-1158.
[18]GOJANI E G,WANG B,LI D P,et al.Anti-Inflammatory Effects of Minor Cannabinoids CBC,THCV,and CBN in Human Macrophages[J].Molecules,2023,28(18):6487.
[19]李俊,朱雪雯,万会花,等.大麻中大麻素类化学成分及其分析方法研究进展[J].中草药,2020,51(24):6414-6425.
[20]杨柳秀,李超然,高雯.大麻化学成分及其种属差异研究进展[J].中国中药杂志,2020,45(15):3556-3564.
[21]Gulck T,Moller B L.Phytocannabinoids:origins and biosynthe-sis[J].Trends Plant Sci,2020,25(10):985-1004.
[22]陈璇,杨明,郭鸿彦.大麻植物中大麻素成分研究进展[J].植物学报,2011,46(2):197-205.
[23]张静,粟建光,唐蜻,等.工业大麻腺毛研究进展[J].河南农业科学,2022,51(2):10-17.
[24]高萍,陈宇娴,柯崇榕,等.新型靶向化合物:植物大麻素的生物合成途径及研究进展[J].生物工程学报,2021,37(6):1968-1985.
[25]XIE Z,MI Y,KONG L,et al.Cannabis sativa:origin and history,glandular trichome development,and cannabinoid biosynthesis[J].Hortic Res,2023,10(9):uhad150.
[26]GAGNE S J,STOUT J M,LIU E W,et al.Identification of olivetolic acid cyclase from Cannabis sativa reveals a unique catalytic route to plant polyketides[J].Proc Natl Acad Sci USA,2012,109(31):12811-12816.
[27]张松涛,陈红丽,崔红,等.植物 MEP 途径的代谢调控机制[J].西北植物学报,2012,32(7):1500-1504.
[28]SUN Q,HE Z,WEI R,et al.Transcription factor CsTT8 promotes fruit coloration by positively regulating the methylerythritol 4-phosphate pathway and carotenoid biosynthesis pathway in citrus(Citrus spp.)[J].Hortic Res,2023,10(11):199.
[29]Bloemendal V R L J,van Hest J C M,Rutjes F P J T.Synthetic pathways to tetrahydrocannabinol(THC):an overview[J].Org Biomol Chem,2020,18(17):3203-3215.
[30]Livingston S J,Rensing K H,Page J E,et al.A polarized supercell produces specialized metabolites in cannabis trichomes[J].Curr Biol,2022,32(18):4040-4047.
[31]Milay L,Berman P,Shapira A,et al.Metabolic Profiling of Cannabis Secondary Metabolites for Evaluation of Optimal Postharvest Storage Conditions[J].Front Plant Sci,2020,11:583605.
[32]Kovalchuk I,Pellino M,Rigault P,et al.The genomics of cannabis and its close relatives[J].Annu Rev Plant Biol,2020,71:713-739.
[33]陈璇,张庆滢,郭蓉,等.不同发育时期大麻素合成相关酶基因表达特征与大麻素含量的相关分析[J].分子植物育种,2018,16(2):583-590.
[34]Prentout D,Razumova O,Rhonéb B,et al.An efficient RNA-seq-based segregation analysis identifies the sex chromosomes of Cannabis sativa[J].Genome Res,2018,30:164-172.
[35]Taura F,Morimoto S,Shoyama Y,et al.First direct evidence for the mechanism of DELTA. 1- tetrahydrocannabinolic acid biosynthesis[J].J Am Chem Soc,1995,117(38):9766-9767.
[36]APICELLA P V,SANDS L B,MA Y,et al.Delineating genetic regulation of cannabinoid biosynthesis during female flower development in Cannabis sativa[J].Plant Direct,2022(6):412.
[37]Zirpel B,Degenhardt F,Martin C,et al.Engineering yeasts as platform organisms for cannabinoid biosynthesis[J].Biotechnol,2017,259:204-212.
[38]姜颖,孙宇峰,韩喜财,等.大麻 THCA 合成酶基因(CsTHCA)RNA 干扰载体的构建及遗传转化[J].植物遗传资源学报,2019,20(1):207-214.
[39]LIU Y,ZHU P,CAI S,et al.Three novel transcription factors involved in cannabinoid biosynthesis in Cannabis sativa L[J].Plant Mol Biol,2021,106(1/2):49-65.
[40]Matchett-Oates L,Spangenberg G C,Cogan N O I.Manipulation of Cannabinoid Biosynthesis via Transient RNAi Expression[J].Front Plant Sci,2021,12:773474.
[41]潘根,陶杰,聂荣,等.大麻 CBDAS 基因家族成员的全基因组鉴定及表达分析[J].华北农学报,2021,36(增刊 1):1-7.
[42]蔡晓雪,植物异源合成大麻二酚基因元件的筛选研究[D].南昌:江西中医药大学,2023.
[43]Zirpel B,Kayser O,Stehle F.Elucidation of structure-function relationship of THCA and CBDA synthase from Cannabis sativa L[J].J Biotechnol,2018,284:17-26.
[44]Deguchi M,Dhir S,Potlakayala S,et al.In planta Female Flower Agroinfiltration Alters the Cannabinoid Composition in Industrial Hemp(Cannabis sativa L.)[J].Front Plant Sci,2022,13:921970.
[45]Aryal N,Orellana D F,Bouie J.Distribution of cannabinoid synthase genes in non-Cannabis organisms[J].J Cannabis Res,2019,1(1),8.
[46]Laverty K U,Stout J M,Sullivan M J,et al.A physical and genetic map ofCannabis sativa identifies extensive rearrangements at the THC/CBD acid synthase loci[J].Genome Res,2019,29(1):146-156.
[47]Thomas F,Kayser O.Improving CBCA synthase activity through rational protein design[J].J Biotechnol,2023,363:40-49.
[48]Fellermeier M,Zenk M H.Prenylation of olivetolate by a hemp transferaseyields cannabigerolic acid,the precursor of tetrahydrocannabinol[J].FEBS Lett,1998,427,283-285.
[49]Saleh O,Haagen Y,Seeger K,et al.Prenyl transfer to aromatic substrates in the biosynthesis of aminocoumarins,meroterpenoids and phenazines:the ABBA prenyltransferase family[J].Phytochemistry,2009,70(15/16):1728-1738.
[50]LUO X,REITER M A,D'ESPAUX L,et al.Complete biosynthesis of cannabinoids and their unnatural analogues in yeast[J].Nature,2019,567(7746):123-126.
[51]Gülck T,Booth J K,Carvalho Â,et al.Synthetic Biology of Cannabinoids and Cannabinoid Glucosides in Nicotiana benthamiana and Saccharomyces cerevisiae[J].J Nat Prod,2020,83(10):2877-2893.
[52]Sands L B,Haiden S R,Ma Y,et al.Hormonal control of promoter activities of Cannabis sativaprenyltransferase 1 and 4 and salicylic acid mediated regulation of cannabinoid biosynthesis[J].Sci Rep,2023,13(1):8620.
[53]Kearsey lJ, Yan C, Prandi N, et al.Biosynthesis of cannabigerol and cannabigerolic acid: the gateways to further cannabinoid production. Synth Biol(Oxf),2023,8(1):ysad010.
[54]Gagne S J,Stout J M,LIU E,et al.Identification of olivetolic acid cyclase from Cannabis sativa reveals a unique catalytic route to plant polyketides[J].Proc Natl Acad Sci USA,2012,109(31):12811-12816.
[55]YANG X,MATSUI T,KODAMA T,et al.Structural basis for olivetolic acid formation by a polyketide cyclase from Cannabis sativa[J].FEBS J,2016,283(6):1088-1106.
[56]Taura F,Tanaka S,Taguchi C,et al.Characterization of olivetol synthase,a polyketide synthase putatively involved in cannabinoid biosynthetic pathway[J].Febs Lett,2009,583(12):2061-2066.
[57 MA J , GU Y , XU P . Biosynthesis of cannabinoid precursor olivetolic acid in genetically engineered Yarrowia lipolytica[J].Commun Biol,2022,5(1):1239.
[58]朱雪雯,米要磊,孟祥霄,等.汉麻聚酮合酶基因家族成员鉴定与表达分析[J].中草药,2023,54(3):886-897.
[59]Stout J M,Boubakir Z,Ambrose S J,et al.The hexanoyl-CoA precursor for cannabinoid biosynthesis is formed by anacyl-activating enzyme in Cannabis sativa trichomes[J].Plant J,2012,71(3):353-365.
[60]Yang J,Adhikari M N,Liu H,et al.Characterization and functional analysis of the genes encoding 1-deoxy-D-xylulose-5- phosphate reductoisomerase and 1-deoxy-D-xylulose-5-phosphate synthase,the two enzymes in the MEP pathway from Amomum villosum Lour[J].Mol Biol Rep,2012,39(8):8287-8296.
[61]Chuang Y C,Hung Y C,Hsu C Y,et al.A Dual Repeat Cis-Element Determines Expression of GERANYL DIPHOSPHATE SYNTHASE for Monoterpene Production in Phalaenopsis Orchids[J].Front Plant Sci,2018,9:765.
[62]Borrego E J,Robertson M,Taylor J,et al.Oxylipin biosynthetic gene families of Cannabis sativa[J].PLoS One,2023,18(4):e0272893.
[63]WANG S,CAO X,MENG X,et al.Characterization and expression analysis of MATEs in Cannabis sativa L,reveals genes involving in cannabinoid synthesis[J].Front Plant Sci,2022,13:1021088.
文章摘自:魏爽,李珊珊,王志刚,等.汉麻中大麻素成分及生物合成途径研究进展[J].高师理科学刊,2024,44(09):64-71.