摘 要:本发明一般涉及生产植物提取物、优选大麻植物提取物的方法。具体地,本发明涉及一种从大麻植物中生产包含Δ9?四氢大麻酚(THC)的大麻植物提取物的方法,包含以下步骤:(a)提供包含足量的Δ9?四氢大麻酚(THC)的大麻植物;(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及(c)用溶剂处理步骤(b)中的花部材料,并从花部材料中分离出包含Δ9?四氢大麻酚(THC)的大麻植物提取物。此外,本发明还涉及一种大麻植物提取物,其包含通过本文所述方法生产/获得的Δ9?四氢大麻酚(THC)。此外,本发明涉及通过本文所述方法生产备/获得的用于医药的大麻植物提取物。此外,本发明涉及通过本文所述方法生产/获得的大麻植物提取物,用于治疗和/或预防慢性癌性疼痛、躯体疼痛、内脏疼痛、中枢神经疼痛、周围神经疼痛和复杂疼痛综合征。
技术要点
1.一种从大麻植物中生产包含Δ9?四氢大麻酚(THC)的大麻植物提取物的方法,包含以下步骤:
(a)提供包含足量的Δ9?四氢大麻酚(THC)的大麻植物;
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用溶剂处理步骤(b)中的花部材料花部材料,并从花部材料花部材料中分离出含有Δ9?四氢大麻酚(THC)的大麻植物提取物。
2.如权利要求1所述的方法,其中所述方法还包含从液态大麻植物提取物中蒸发溶剂,以浓缩提取物。
3.如权利要求2所述的方法,其中所述方法还包含将浓缩的大麻植物提取物加热至50℃至150℃的温度,以使四氢大麻酚酸(THCA)脱羧成Δ9?四氢大麻酚(THC)。
4.如权利要求1至3中任一项所述的方法,其中大麻植物包含按干重计含量至少为1%(w/w)的Δ9?四氢大麻酚(THC)。
5.如权利要求1至4中任一项所述的方法,其中权利要求1步骤(b)中定义的大麻植物花部材料的干燥步骤在20℃至35℃的温度范围内进行,直到花部材料的含水量少于10%。
6.如权利要求1至5中任一项所述的方法,其中权利要求1步骤(c)中定义的处理步骤包含以下步骤:
(i)以约1:8.4(w/w)的比例将花部材料用溶剂覆盖,从而得到花部材料与溶剂的混合物;
(ii)在15℃至25℃的温度和避光条件下浸渍约24h;
(iii)再次添加溶剂,从而得到花部材料和溶剂比例约为1:16.8(w/w)的混合物;
(iv)进行渗滤,其中在15℃至25℃的温度和避光条件下,使溶剂以每千克花部材料3.55至5.45ml/min的流速渗入花部材料中,持续63至97h;以及
(v)从大麻花部材料中分离出大麻植物提取物。
7.如权利要求1至6中任一项所述的方法,其中权利要求6的步骤(v)中定义的分离步骤包含以1.5μm的沉积速率过滤大麻植物提取物。
8.如权利要求1至7中任一项所述的方法,其中所述溶剂选自乙醇、丁醇、烷烃(如戊烷、庚烷和丙烷)、乙醚、叔丁基甲基醚、甲基乙基酮、丙酮、乙酸乙酯和CO2。
9.如权利要求1至8中任一项所述的方法,其中所述方法不涉及冬化步骤。
10.一种大麻植物提取物,其包含通过权利要求1至9中任一项所述的方法获得的Δ9四氢大麻酚(THC)。
11.如权利要求10所述的大麻植物提取物,其中所述植物提取物为液态。
12.如权利要求10或11所述的大麻植物提取物,其中所述植物提取物为无溶剂和脱羧形式。
13.如权利要求10至12中任一项所述的大麻植物提取物或通过权利要求2至9中任一项所述的方法获得的大麻植物提取物,其中大麻植物提取物包含按提取物重量计含量约为60%的Δ9?四氢大麻酚(THC)。
14.如权利要求10至13中任一项所述的大麻植物提取物或通过权利要求1至9中任一项所述的方法获得的大麻植物提取物,其中大麻植物提取物还包含选自由α?红没药醇、愈创醇和/或β?石竹烯的一种或多种萜烯。
15.如权利要求10至14中任一项所述的大麻植物提取物或通过权利要求1至9中任一项所述的方法获得的大麻植物提取物,其用于医药。
16.如权利要求10至14中任一项所述的大麻植物提取物或通过权利要求1至9中任一项所述的方法获得的大麻植物提取物,其用于治疗和/或预防慢性癌性疼痛、躯体疼痛、内脏疼痛、中枢神经疼痛、周围神经疼痛或复杂疼痛综合征。
17.一种治疗和/或预防慢性癌性痛、躯体疼痛、内脏疼痛、中枢神经疼痛、周围神经疼痛或复杂疼痛综合征的方法,其包含施用权利要求10至14中任一项所述的大麻植物提取物或通过权利要求1至9中任一项所述的方法获得的大麻植物提取物。
发明内容
本发明具体涉及植物提取物、优选大麻(Cannabis)植物提取物的生产方法。本发明具体涉及一种从大麻植物中生产包含Δ9?四氢大麻酚(THC)的大麻植物提取物的方法,包含以下步骤:
(a)提供包含足量的Δ9?四氢大麻酚(THC)的大麻植物;
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用溶剂处理步骤(b)中的花部材料,并从花部材料中分离出含有Δ9?四氢大麻酚(THC)的大麻植物提取物。
此外,本发明还涉及一种包含Δ9?四氢大麻酚(THC)的大麻植物提取物,该提取物是通过本文所述方法生产/获得的。此外,通过本发明所述方法生产/获得的大麻植物提取物可用于医药。此外,通过本发明所述方法生产/获得的大麻植物提取物,可用于治疗和/或预防慢性癌性疼痛、躯体疼痛、内脏疼痛、中枢神经疼痛、周围神经疼痛或复杂疼痛综合征。
大麻长期以来就被视为一种草药。然而,直到19世纪,人们才对其进行了更为系统的研究,并将其用于医疗。不久之后,在20世纪初,多数大麻的研究被再次中止,因为人们认为大麻的精神活性作用及由此产生的滥用超过了其作为药物来源的益处。如今,在多数司法管辖区,大麻仍被视为一种非法药物,并因此受到广泛的立法监管。仅在近期,鉴于大麻作为一种滥用药物的风险状况发生变化,上述立法规定在世界某些地区得到部分放宽。
大麻作为草药的主要活性物质是大麻素(cannabinoid)。大麻素是源自大麻植物的一类物质。其中一个最重要的大麻素是具有精神活性的Δ9?四氢大麻酚(THC)。然而截至目前,已在大麻植物中发现100多种大麻素,其中多数不具有精神活性。这些大麻素中的大多数与THC类似,水溶性较差,但在烃类、醇类等有机溶剂中溶解性较好。许多大麻素,特别是大麻素与大麻植物中其他物质的混合物,在多种医学适应症中均有研究,包括但不限于神经病性疼痛、纤维肌痛、类风湿性关节炎和混合性慢性疼痛(Bridgeman,M.B.&Abazia,D.T.,“Medical Cannabis:History,Pharmacology,and implications for the acute care setting”,P&T 42(3),2007,第180?188页)。
更具体的说,研究发现植物来源的大麻药用提取物在缓解多发性硬化症、脊髓损伤、臂丛神经损伤和神经纤维瘤病导致的跛行截肢患者的疼痛方面优于安慰剂。研究发现,THC和大麻二酚(CBD)单独使用以及按照1:1的CBD:THC比例混合使用均具有疗效(Wade,D.T.等人,Clin.Rehabil.2003,17(1),第21?29页)。
与THC和安慰剂相比,使用全植物提取物也获得了类似的结果,而在治疗多发性硬化症患者疼痛和痉挛方面,全植物提取物比THC略有优势,但在统计学上不存在显著差异(Zajicek J等人,Lancet.2003,362(9395),第1517?1526页)。
因此,为发现大麻全植物提取物中多种大麻素和其他物质的复杂相互作用,又进行了进一步的研究,结果发现在大鼠模型中,CBD确实表现出抗痛觉和抗过敏效果,从而缓解疼痛。在这项更加机制导向的研究中,提取物的其他成分(如萜烯和类黄酮(flavonoid)),被认为可能协同促进了CBD的此类活性。此外,研究还发现大麻的镇痛效果不仅来源其抗痛觉作用,还受到其抗炎作用的影响(Comelli F.等人,Phytotherapy Research 2008,22(8),第1017?1024页)。
因此,针对抗炎活性及主要大麻素(如四氢大麻酚酸(THC(A))形式的THC和大麻二酚(CBD))与大麻提取物中其他成分之间复杂的相互作用进行了进一步研究。结果发现,THC(A)在高剂量下被认为是主要的抗炎活性成分,而CBD仅在低剂量时具有抗炎活性,而在高剂量时具有细胞毒性。在使用HCT116和CaCO2细胞的细胞培养模型中进一步发现,大麻提取物在减少炎症方面比单独的单一大麻素甚至更有活性,而当比较大麻属的新鲜花部和烘干花部提取物时,抗炎活性已存在差异。对大麻提取物进行分馏,但并未明确找到哪些单一化合物在分馏物中对归因于CBD和/或THC(A)的主要活性做出了实际贡献(Nallathambi R.等人,Cannabis and Cannabinoid Research 2017,2(1),第167?182页)。
如今,毫无疑问,这些细胞毒性(因此可能与癌症治疗相关)和抗炎活性不仅主要源自主要成分THC(A)和/或CBD。上述萜烯也有贡献,然而这些萜烯在大麻植物的各个品种之间存在明显的差异(Gallily R.等人,Cannabis and Cannbinoid Research 2018,3(1),第282?290页)。具体地,植物生理学已经证实,也可以根据相关的萜烯模式来区分优选含有CBD的大麻植物和主要含有THC(A)的大麻植物。因此,主要源自CBD和/或THC(A)的某些细胞毒性作用和潜在的其他作用(如抗炎或镇痛/抗过敏作用)均受到与此类主要大麻素相关的特定的一组萜烯的影响。例如,CBD作为一种细胞毒性药物具有活性,与萜烯愈创木酚和α红没药醇有关,研究发现,只有与主要的植物大麻素(phytocannabinoid)结合,这些萜烯才能发挥活性,而主要植物大麻素的活性只能通过这些特定的萜烯来提高。这被称为植物大麻素的“随行效应(inter?entourage effect)”(Namdar D.等人,Molecules 2019,24(3031),第1?17页)。
因此,人们致力于研究从大麻植物中提取药用活性物质的工艺,希望最大限度地提取大麻素以及萜烯、萜类和/或类黄酮物质。此外,保持上述药理活性物质的相对浓度也是有益的,这样可以保持这些物质在作为药物使用时潜在的协同作用。同时,通常还需要去除固体和蜡,以获得可进一步纯化和/或化学处理的纯提取物。已有多种大麻植物提取物和相应用途的描述,但并未附带具体的生产方法(如WO 2020/006598和WO 2020/006599)。
上述目标受到通用、环境和经济等条件的进一步制约。例如,在提取物的制备过程中,尽量减少(有机)溶剂和/或能量的用量是有益的。
相应地,已经评估了采用超临界CO2作为溶剂的复杂分离技术,该溶剂可以在最终产品中去除且没有(药用)相关残留物(如WO 2002/064109A2中描述)。DE 103 37 458A1公开了一种利用液态CO2从大麻植物材料中提取药理活性物质混合物的工艺。根据DE 103 37 458A1,液态CO2的使用优于超临界CO2,因为它可以更好地将蜡与整体植物材料混合物分离。然而,使用液态CO2或超临界CO2需要特殊设备来产生和控制液态或超临界CO2工作所需的高压。此外,为了去除上述蜡,DE 103 37 458A1中描述的工艺需要对提取物进行后处理,即在?20℃下将提取物与乙醇按2:1的比例处理约48h。
DE 103 37 458A1中使用乙醇(或低温使用任何其他醇类溶剂)的后处理步骤通常被称为“冬化(winterization)”(在使用超临界CO2的工艺中也需要冬化,如WO 2002/064109A2或任何其他利用有机和/或醇提取大麻植物材料的提取工艺(如WO 2013/165251)中所述)。
因此,所有施用提取物中含有大麻素的原理的提取工艺,无论使用何种溶剂,都需要随后通过冬化或类似的后处理技术去除提取物中的蜡。
另一种替代性的提取技术也是众所周知的,它的原理则完全颠倒,是从植物材料中提取水溶性物质,使得产生的残留物(不可避免地是固体)富含大麻素。这些技术已经得到改进,并已有相关出版物,然而其目标与试图获得一种可以在受监管的制药环境中方便使用的产品的目标不同。例如,已经描述了一种工艺,该工艺使用剪碎的大麻植物或剪碎的从植物的茎叶中分离的大麻花,然后放入半渗透袋中置于冷水中(Cervantes,J.,“Marijuana Horticulture,the indoor/outdoor medical grower’s bible”,Van Patten Publishing 2006,第402页;“Ice?O?Lator instructions”)。然而,这些技术并不能去除含有大麻素的分馏物中的蜡。
因此,从相关的油相中去除上述蜡已经成为大麻植物提取物生成过程中的实际问题。综上所述,现在仍然需要一种改进的工艺来生产适合后续制药用途的大麻植物提取物。这种工艺还应最大限度地提高药用活性大麻素(或其前体)的含量,并保持其相对浓度。换言之,提取物优选地基本上不含蜡和其他非特异性脂溶性物质,但优选地包含植物中自然存在的基本所有大麻素,最优选地是与它们在整株大麻植物中的比例基本相同。在本发明的背景下,提取物(优选根据本发明提供方法获得的大麻植物提取物或大麻植物浸膏(soft extract))按重量计优选包含少于3%、2.1%或2%的蜡。
此外,出于环境、商业以及药学等多重原因考虑,该工艺应当尽量减少溶剂和能量的使用。因此,需要改进生产大麻植物提取物的手段和方法。
本发明的技术问题是提供一种生产大麻植物提取物的改进的手段和方法。
通过权利要求书中描述的和下文提供的实施方案,解决了技术问题并满足了上述需求。
本发明涉及一种从大麻植物中生产包含Δ9?四氢大麻酚(THC)的大麻植物提取物的方法,包含以下步骤:
(a)提供包含足量的Δ9?四氢大麻酚(THC)的大麻植物;
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用溶剂处理步骤(b)中的花部材料,并从花部材料中分离出含有Δ9?四氢大麻酚(THC)的大麻植物提取物。
此外,本发明还涉及一种大麻植物提取物,其包含可通过本文所述方法获得/生产的Δ9?四氢大麻酚(THC)。通过本文所述方法获得的大麻植物提取物也可称为大麻植物提取物(以下也称为“大麻植物浸膏”)。
根据本发明的方法的特征在于,所使用的植物材料以这样的方式处理,使得进入后续醇类和/或有机提取步骤的材料主要由花朵/花部材料组成,或优选仅由花朵/花部材料组成。在本发明的背景下,术语“主要由……组成”以如下方式理解,即植物材料中按重量计最多1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%或20%是例如叶、根等植物材料,换言之,术语“主要由……组成”是指植物材料中按重量计最多80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%是花部材料。
本发明解决了上述确定的技术问题,因为如本文所记载的,已经令人惊讶地和出乎意料地发现了一种方法,其无需冬化步骤。因此,本发明涉及一种无需冬化步骤的大麻植物提取物的生产方法。换言之,本发明涉及一种不包括冬化步骤的大麻植物提取物的生产方法。去除冬化步骤可以减少生产大麻植物提取物所需的(有机)溶剂用量。此外,去除冬化步骤还能减少生产大麻植物提取物所需的能量。尽管去除了冬化步骤,但通过本文所述方法生产/获得的大麻植物提取物或大麻植物浸膏含有优异浓度的药用活性物质,如大麻素。尽管去除了冬化步骤,但通过本文所述方法生产/获得的大麻植物提取物仍含有优异浓度的THC(如按大麻植物提取物重量计至少约70%)。此外,根据本文所述方法生产的大麻植物提取物含有相对于彼此优异且高度期望的药用活性成分的浓度。此外,根据本文所述方法生产的大麻植物提取物不含或仅含极少量的可皂化物质(如,按提取物重量计小于约8%)。因此,通过本文所述方法生产的大麻植物提取物是一种可药用的提取物。
这尤其令人惊讶,因为本文所述的方法使用大麻的花朵/花部材料,其通常包含最大量的大麻素,但也包含蜡。因此,完全出乎意料且令人惊讶的是,可以省略冬化步骤而不影响所获得大麻植物提取物的质量。此外,本文所述的方法允许使用乙醇作为溶剂生产具有优异THC浓度(例如按大麻植物提取物重量计至少约70%)的大麻植物提取物。与现有技术方法中使用的超临界CO2相比,使用乙醇允许使用更简单的设备。
本文所述方法允许生产出具有所需浓度的药用活性物质的大麻植物提取物。本文所述方法允许生产出具有所需浓度大麻素的大麻植物提取物。因此,本文所述方法允许生产出具有所需浓度的CBD和/或THC(A)(优选为Δ9?四氢大麻酚)的大麻植物提取物。本文所述的方法允许生产出具有所需浓度大麻素(优选为Δ9?四氢大麻酚)和/或萜烯的大麻植物提取物。本文所述的方法允许生产出具有本文和上文直接提到的所需浓度的药用活性物质的大麻植物提取物,且不含或仅含极少量不需要的蜡。令人惊奇的是,本文所述方法可以在不进行冬化步骤的情况下生产所述大麻植物提取物。
下面将更详细地介绍本发明。
本发明具体涉及以下各项。
[1]一种从大麻植物中生产包含Δ9?四氢大麻酚的大麻植物提取物的方法,包含以下步骤:
(a)提供包含足量的Δ9?四氢大麻酚(THC)的大麻植物;
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用溶剂处理步骤(b)中的花部材料,并从花部材料中分离出含有Δ9?四氢大麻酚(THC)的大麻植物提取物。
[2]第1项的方法,其中该方法还包含从液态大麻植物提取物中蒸发溶剂以浓缩提取物。
[3]第2项的方法,其中该方法还包含将浓缩的大麻植物提取物加热至50℃至150℃,优选80℃,使四氢大麻酚酸(THCA)脱羧成Δ9?四氢大麻酚(THC),优选在175mbar至195mbar的真空压力下、更优选在约185mbar的真空压力下进行。
[4]第1至3项中任一项的方法,其中大麻植物包含Δ9?四氢大麻酚(THC),其含量按干重计至少为1%、2%、3%、4%、5%、6%、7%、8%、9%或优选10%(w/w)。
[5]第1至4项中任一项的方法,其中第1项步骤(b)中定义的大麻植物花部材料的干燥步骤在20℃至35℃的温度范围内进行至少4天(96h)或直到花部材料的含水量少于10%。
(ii)在15℃至25℃的温度和避光条件下浸渍约24h;
(iii)再次添加溶剂,从而得到花部材料和溶剂比例约为1:16.8(w/w)的混合物;
(iv)进行渗滤,其中在15℃至25℃的温度和避光条件下,溶剂以每千克花部材料3.55至5.45ml/min、优选为每千克花部材料4.0ml/min的流速渗入花部材料中,持续63至97h,优选86h;以及
(v)从大麻花部材料中分离出大麻植物提取物。
[7]第1至6项中任一项的方法,其中第6项步骤(v)中定义的分离步骤包括以1.5μm的沉积速率过滤大麻植物提取物。
[8]第1至7项中任一项的方法,其中溶剂选自乙醇、丁醇、烷烃(如戊烷、庚烷和丙烷)、乙醚、叔丁基甲基醚、甲基乙基酮、丙酮、乙酸乙酯和CO2,优选乙醇,更优选96vol.%的药用级乙醇。
[9]第1至8项中任一项的方法,其中所述大麻植物为DKJ127(由欧盟植物品种局保存,申请号为A202104053)。
[10]第1至9项中任一项的方法,其中该方法不包括冬化步骤。
[11]一种包含Δ9?四氢大麻酚(THC)的大麻植物提取物,可通过第1至10项中任一项的方法获得。
[12]第11项的大麻植物提取物,其中植物提取物为液态。
[13]第11项或第12项的大麻植物提取物,其中植物提取物为无溶剂和脱羧形式。
[14]第11至13项中任一项的大麻植物提取物,或通过第2至10项中任一项的方法获得的大麻植物提取物,其中大麻植物提取物包含Δ9?四氢大麻酚(THC),其含量按提取物重量计至少为约50%、60%或70%,优选按提取物重量计为约60%至80%,更优选按提取物重量计为约70%至74%。
[15]第11至14项中任一项的大麻植物提取物,或可通过第1至10项中任一项的方法获得的大麻植物提取物,其中大麻植物提取物还包含选自α?红没药醇、愈创醇和β?石竹烯的一种或多种萜烯。
[16]第11至15项中任一项的大麻植物提取物,或可通过第1至10项中任一项的方法获得的用于药物的大麻植物提取物。
[17]第11至15项中任一项的大麻植物提取物,或可通过第1至10项中任一项的方法获得的大麻植物提取物,用于治疗和/或预防慢性癌性疼痛、躯体疼痛、内脏疼痛、中枢神经疼痛、周围神经疼痛或复杂疼痛综合征。
[18]一种治疗和/或预防慢性癌性疼痛、躯体疼痛、内脏疼痛、中枢神经疼痛、周围神经疼痛或复杂疼痛综合征的方法,包括施用第11至15项中任一项的大麻植物提取物或通过第1至10项中任一项的方法获得的大麻植物提取物。
本文所述本发明方法中的公开内容适用于相应的用途,反之亦然。
如上所述,本发明涉及一种生产植物提取物的方法。这意味着提取物是从植物材料中生产/获得的。换言之,植物提取物是根据本文所述方法通过提取植物材料生产/获得的。具体地,本发明涉及一种生产(a)大麻植物提取物的方法。这意味着提取物是从大麻植物中生产的。换言之,大麻植物提取物是通过按照本文所述方法提取大麻植物材料生产的。
因此,本发明涉及一种生产大麻植物提取物的方法,包含以下步骤:
(a)提供大麻植物,其优选包含足量的Δ9?四氢大麻酚(THC);
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用溶剂处理步骤(b)中的花部材料,并从花部材料中分离出大麻植物提取物。
本发明还涉及一种生产大麻植物提取物的方法,包含以下步骤:
(a)提供大麻植物,其优选包含足量的Δ9?四氢大麻酚(THC);
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用溶剂处理步骤(b)中的花部材料,并从花部材料中分离出大麻植物提取物。
本发明还涉及一种生产大麻植物提取物的方法,包含以下步骤:
(a)提供大麻植物,其优选包含足量的Δ9?四氢大麻酚(THC);
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用溶剂处理步骤(b)中的花部材料,并从花部材料中分离出大麻植物提取物;
其中,步骤(c)中定义的处理步骤包含以下步骤:
(i)以约1:8.4(w/w)的比例将花部材料用溶剂覆盖,从而得到花部材料与溶剂的混合物;
(ii)在15℃至25℃的温度和避光条件下浸渍约24h;
(iii)再次添加溶剂,从而得到花部材料和溶剂比例约为1:16.8(w/w)的混合物;
(iv)进行渗滤,其中在15℃至25℃的温度和避光条件下,溶剂以每千克花部材料3.55至5.45ml/min、优选每千克花部材料4.0ml/min的流速渗入花部材料中,持续63至97h,优选86h;以及
(v)从大麻花部材料中分离出大麻植物提取物。
在本发明中,步骤(i)至(v)按先后顺序进行。
在本发明的背景下,术语“植物”指的是植物界中各种光合作用的真核多细胞生物,其特征是产生胚胎、含有叶绿体、具有纤维素细胞壁并且缺乏运动能力。本文所用的“植物”包括处于任何发育阶段的任何植物或植物的一部分以及含有大麻素、萜烯和萜类化合物的子代。植物材料可从固体植物材料中获得,但不限于此。固体植物材料可来自整株植物或其部分,包括但不限于植物细胞、植物器官、叶、茎、果实、根、分生组织、植物种子、原生质体、愈伤组织以及任何组织成结构和/或功能单元的植物细胞群。或者,植物材料可为植物细胞培养物,特别是液体培养基中的植物悬浮细胞培养物。本领域技术人员已知的由固体植物材料建立离体植物细胞培养的方法包含离体培养愈伤组织再生(Espinosa?Leal等人,Planta(2018),248,第1–18页)。对本领域技术人员来说,本文对一般植物的描述同样适用于大麻植物。
“大麻植物”可与“大麻植物材料”互换使用。可以使用大麻植物的任何部分,包括但不限于毛状体、花蕾、花苞、叶片、茎秆和可能含有大麻素的任何其他植物部分。含有大麻素的优选部位是花、毛状体和糖叶(sugarleaf)。此外,虽然雌株产生的大麻素浓度可能高于雄株植物,但雌株(包括“雌化植物”)和雄株均可使用。本文术语“花部(flower)”、“花部材料(flowermaterial)”和“花朵(blossom)”可以互换使用。本领域技术人员可知在大麻植物中,花朵排列成所谓的“花穗(colas)”。因此,本文中所使用的花部材料也指的是这些花穗。
大麻植物的叶子可分为扇叶(fanleaf)和糖叶。扇叶是大麻植物上的大的初生叶。糖叶在大麻植物的开花阶段从大麻花朵中发育并生长出。如下文所详细描述,所述糖叶或其部分可在本文所述的方法中从花部材料部料中去除。
大麻植物材料的毛状体(即树脂腺)是大麻植物(主要来自花蕾)表面近乎微小的蘑菇状突起物。毛状体虽然相对复杂,但主要由茎和头部组成。大麻素(如THC)主要在毛状体的头部产生。大麻素集中在植物的毛状体中。因此,对于本领域技术人员显而易见的是,本文所述的所有方法均可使用大麻植物的(分离的)毛状体来进行。毛状体的分离可以按照现有技术描述进行(如Cerantes,J.,“Marijuana Horticulture,the indoor/outdoor medical grower’s bible”,Van Patten Publishing 2006,第402页;“Ice?O?Lator Instructions”)。
在本发明中,当大麻植物用于本文所述方法时,植物材料优选取自该植物的花部。此外,在本发明中,用于本文所述方法的植物材料可以从天然植物或转基因植物中获得。
在本发明中,用于获取提取物的植物材料可以是新鲜的、干燥的、冻干的或冷冻的,但优选为干燥的。
本文所用的“干燥”是指植物材料中的水/水分减少。植物材料的干燥可以通过任何方式进行,如在干燥室中将植物材料放在空气流动的托盘上,在20℃至35℃的温度范围内(即:20℃、21℃、22℃、23℃、24℃、25℃、26℃、27℃、28℃、29℃、30℃、31℃、32℃、33℃、34℃、35℃或其任意部分)持续至少1天、2天、3天或4天,优选4天(96h),或直到花部材料的含水量少于10%。本领域技术人员知道如何通过标准方法测量温度。此外,本领域技术人员还知道如何测定植物材料的含水量,特别是干燥的大麻花部的含水量(如《欧洲药典》(European Pharmacopeia)第10版第2.2.32章所述)。因此,本文所述方法步骤(b)中定义的大麻植物花部材料的干燥步骤可以在干燥室中进行,如将植物材料、优选为花部材料放在空气流动的托盘上,在20℃至35℃的温度范围内(即20℃、21℃、22℃、23℃、24℃、25℃、26℃、27℃、28℃、29℃、30℃、31℃、32℃、33℃、34℃、35℃或其任意部分)持续至少1天、2天、3天或4天,优选4天(96h)或直到花部材料的含水量少于0%。
优选地,植物材料经过修剪。因此,本文所述方法中使用的花部材料是经过修剪的。
本文所述“花部材料的修剪”是指从花部上去除叶片,特别是糖叶和/或扇叶。具体地,剪掉糖叶突出花朵的可见部分。花部材料的修剪可按下文所述进行。
大麻植物的花部可以手动(如用剪刀)或用去茎器(destalker)(如MB Bucker 500;Master Bucker 500;www.masterproducts.es)与植物的其他部分分离。
随后修剪未干燥的花部以将糖叶从花部分离出来。该步骤可手工完成(如用剪刀),也可以用修剪机(trimmer)(如MT Tumbler 500MED;MT Tumbler 500MED;masterproducts.es)。
可在本文所述方法中使用的修剪器的功能如下:
(a)将未干燥的花部或干燥的花部放入不锈钢制成的旋转滚筒中。
(b)花部通过滚筒的速度可以通过调整滚筒的倾斜角度来调节。新加入的花部会输送到出口处。大约每30秒加入一把花,并在滚筒中停留约30至45秒。
(c)超出滚筒开口的糖叶由滚筒下方的滚筒刀片去除。
为了提高每分钟的产量,可以将多台修剪机串联起来,以较短的间隔添加材料。
糖叶的去除是可选的。与扇叶相比,糖叶表面的毛状体数量也较少。由于渗滤器(提取容器)只能装入一定量的原料,因此可以去除糖叶以尽可能提高提取原料中的THC含量。本领域技术人员可以很容易选择合适的植物原料装入渗滤器。例如,对于1,000升的渗滤器,可使用10至25kg的植物原料。
除修剪外,还可对用于本文所述方法的植物材料进行粉碎,以产生较小尺寸的植物材料。换言之,植物材料也可以在与溶剂混合时或优选在与溶剂混合之前进行机械粉碎。本领域技术人员熟知的所有破碎方法均适用于将植物材料粉碎成较小的碎片,包括粉碎、研磨、铣削、磨碎和切片。然而,在本文所述的方法中,优选使用已修剪过糖叶可见部分的整个花部。大麻素和萜烯化合物位于花的表面,无需粉碎就能轻松接触到提取溶剂。在不拘泥于科学理论约束的前提下,可以设想较小的颗粒增加了与溶剂的接触面,从而提高了对不需要的物质/材料的提取率。换言之,提取更小的颗粒可能会得到更多的非活性成分。
如上所述,大麻植物提取物优选是通过本文所述的方法生产/获得。因此,大麻植物提取物是通过按照本文所述方法提取大麻植物材料生产得到的。
本文使用的术语“大麻植物(Cannabis plant)”具有最广泛的含义,包括野生型大麻(Cannabis sativa)及印度大麻(Cannabis indica)及其所有变体,如印度大麻亚种(Cannabis sativa subspecies indica),包括变体var.Indica和var.kafirinistanica、Cannabis indica subsp.indica var.indica、Cannabis indica subsp.indica var.himalayensis、Cannabis indica subsp.indica var.afghanicah和Cannabis indica subsp.indica var.asperrima。此外,还包括上述植物和大麻化学变种的遗传杂交、自交或杂交产生的大麻植物。上述所有种类的大麻植物材料均可用于本文所述的方法。本文所述方法优选使用花部材料。本文中的术语“大麻品种”和“大麻植物品种”可以互换使用。本领域已知的大麻品种有,例如Jack Herer、Chemdawg、Bubba Kush、Trainwreck、Super Silver Haze、Pure Kush、El Nino、Himalayan Gold、Skunk#1、White Widow、Warlock CBD、Pink Kush、OG Kush、Super Lemon Haze、Jack the Ripper、Lemon Skunkh和Hash Plant。
通过培育特定的大麻化学变种(chemovar),可以制备出方便配比的含THC和CBD的药物,即大麻植物提取物。这些化学品种(根据所产生的大麻素而不是植物的形态特征来区分的植物)可以通过本领域技术人员熟悉的各种植物育种技术进行培育。通过插条(cutting)繁殖植物作为生产材料可确保基因型固定不变,且每一茬植物含有的大麻素比例基本相同。
大麻植物会自然产生多种多样的次生代谢物,包括大麻素、萜烯和萜类、甾醇、甘油三酯、烷烃、角鲨烯、生育酚等。这些次生代谢物的混合取决于多种因素,包括具体的大麻品种、待提取的大麻植物部位、提取方法和提取物的加工方式。
因此,本领域技术人员理解,不同的大麻品种含有不同含量/浓度的(药用活性)物质,如大麻素或萜烯。因此,对于本领域技术人员显而易见的是,通过本文所描述的方法生产的大麻植物提取物中(药用活性)物质的浓度可以通过使用含有一定浓度的(药用活性)物质的大麻植物品种进行控制。例如,可以使用包含高浓度THC的大麻品种来生产含有高浓度THC的大麻植物提取物,而可以使用包含高浓度CBD的大麻品种生产含有高浓度CBD的大麻植物提取物。因此,本领域技术人员可以根据大麻素的相对比例来选择大麻植物品种。任何特定大麻品种的大麻素精确含量都可以使用本领域技术人员熟知的方法如薄层色谱法(TLC)或高效液相色谱法(HPLC)进行定性和定量测定。
本文提到的或本领域已知的任何大麻品种均可用于本文所述的方法。尽管对本领域技术人员是显而易见的,但仍需注意,不同大麻变种的混合体也可以用于本文所述的方法。
本文所述方法中使用的大麻植物可以通过高THC浓度的选择来获得。例如,可以按以下方式进行选择:可以从市场上获得大麻植物种子,例如“Jack Herer”品系的种子。种子可以通过本领域技术人员已知的普通栽培方法进行栽培,例如栽培3到14天,直到发芽。根据发芽和生长情况,本领域技术人员可以选择特定的种子进行进一步培育。一般可根据分析结果和/或栽培过程中的观察结果做出此类决定。一旦选定的种子发芽生根,就可以通过本领域技术人员已知的普通栽培方法进一步栽培3至6周,以建立种子植物种群。施肥、供水、病虫害防治、疾病监测和植物修剪可由本领域技术人员进行优化。根据植物的生长情况,本领域技术人员可以选择特定的植物种子进行进一步培育。可以从这些选定的植物(下文中称为单株植物)中获取插条以获得单株植物的遗传物质。然后,可通过将日照时间从大于18h减少至小于12h,使单株植物进入开花期。一般来说,此时需要满足生根期、无性繁殖期和开花期的环境条件。随后,可根据以下标准最终选择单株植物:生长行为、开花行为、成功栽培和从其获得的插条的良好生根行为、对疾病(如灰霉病)的敏感性,以及例如针对THC含量、其他大麻素含量和萜烯含量的分析结果。作为选择过程的一部分,可以根据大麻素和萜烯谱分析不同批次之间的一致性。最优选地,用于本文所述方法的大麻品种是本文中称为DKJ127的品种,该品种由欧盟植物品种局保存(由Vertanical GmbH保存,申请号为A202104053(品种临时名称:dk?j127;植物分类学:Canabis sativa L.,育种者编号:DKJ127;品种名称:DKJ127;申请号:2021/3223;电子申请号:A202104053;欧盟植物品种局接收日期:09/12/2021))。尽管对技术人员是显而易见的,但仍需注意,品种DKJ127的子代也可用于本文所述的方法。这些子代的THC浓度甚至可以高于DKJ127。
因此,本发明涉及一种生产大麻植物提取物的方法,包含以下步骤:
(a)提供一株大麻品种为DKJ127的大麻植物(即由欧盟植物品种局保存的申请号为A202104053的大麻植物);
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用溶剂处理步骤(b)中的花部材料,并从花部材料中分离出大麻植物提取物。
本发明还涉及一种生产大麻植物提取物的方法,包含以下步骤:
(a)提供一株大麻品种为DKJ127的大麻植物;
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用溶剂处理步骤(b)中的花部材料,提取大麻植物提取物;
其中,步骤(c)中定义的处理步骤包含以下步骤:
(i)以约1:8.4(w/w)的比例将花部材料用溶剂覆盖,从而得到花部材料与溶剂的混合物;
(ii)在15℃至25℃的温度和避光条件下浸渍约24h;
(iii)再次添加溶剂,从而得到花部材料和溶剂比例约为1:16.8(w/w)的混合物;
(iv)进行渗滤,其中在15℃至25℃的温度和避光条件下,溶剂以每千克花部材料3.55至5.45ml/min、优选每千克花部材料4.0ml/min的流速渗入花部材料中,持续63至97h,优选86h;以及
(v)从大麻花部材料中分离出大麻植物提取物。
大麻素被描述为仅在大麻植物中发现的独特萜酚代谢物(Sirikantaramash和Taura,Springer 2017,第1版,第8章,第183?206页)。然而,在其他植物物种中也能发现替代的大麻素样物质(cannabinoid?like substance)或大麻素类化合物(cannabimimetic compound),包括桂圆菊(Acmella oleracea)(Dallazan等人,Inflammopharmacology 2019,28,第175–186页)、狭叶紫锥菊(Echinaceae angustifolia)(Raduner等人,J Biol Chem.2006,281(20),第14192–14206页)、紫锥菊(Echinaceae purpurea)(Raduner等人,J Biol Chem.2006,281(20),第14192–14206页)、蜡菊(Helichrysum umbraculigerum) (Pollastro等人,Fitoterapia 2018,126,第35?39页)、赛菊芋(Heliopsis helianthoides)(Hajdu等人,J Nat Prod.2014,77(7),第1663?1669页)、玛咖(Lepidium meyenii)(Hajdu等人,J Nat Prod.2014,77(7),第1663?1669页)、卡瓦胡椒(Piper methysticum)(Ligresti等人,Pharmacol Res.2012,6(2),第163?169页)、黑胡椒(Piper nigrum)(Reynoso?Moreno等人,J Agric Food Chem.2017,65(43),第9435?9442页)、 Radula marginata(Hussain等人,Phytochem rev.(2019),18,第953–965页)、直瓣扁萼苔(Radula perrottetii)(Chicca等人,Neurophysiol.2018,4(10))、烈香杜鹃(Rhododendron anthopogonoides)(Iwata and Kitanaka,Chem Pharm Bull.2011,59(11),第1409?1412页)以及黑孢块菌(Tuber melanosporum)(Degenhardt等人,Biology,Pharmacology,Diagnosis,and Treatment 2017,第2章,第13?23页)、(Pacioni等人, Phytochemistry 2015,110,第104?110页)。目前认为大麻素样物质或大麻素类化合物是与内源性大麻素(endocannabinoid)系统相互作用并具有与大麻素类似药理作用的植物化学物质和次生代谢物。
在本发明中,术语“提取物”在没有进一步说明的情况下,通常指任何形式的提取产物,可选择减去提取剂,而不论其物理形态(即粘性、糊状或固体)。
或者,本文所述的方法可以使用一种能够产生大麻素、大麻素样物质或大麻素类化合物以及萜烯和/或萜类化合物但并不内源性地含有或产生这些物质的植物。这意味着本文所述方法所用的植物可为转基因植物,其经过基因改造以生产所需的物质(如大麻素和/或萜烯和/或萜类化合物)。因此,本领域技术人员将理解,本文所述方法中使用的植物可能是转基因植物或植物细胞,其由于基因改造而与天然存在的植物不同。转基因植物或植物细胞并非天然存在的,即无法在自然界中找到,并且由于引入了外来遗传物质(如外来核酸分子),因此与天然存在的植物或植物细胞有较大差异。
根据设想,本文所述方法用于生产植物提取物,优选为大麻植物提取物,其中包含(药用活性)物质,如大麻素、萜烯和/或萜类化合物。本文所用术语“大麻素”是指从植物中分离出的或合成的在内源性大麻素系统中具有活性的任何大麻素,包含大麻素样物质和/或大麻素类化合物。由植物来源合成的大麻素视为植物大麻素(phytocannabinoid),即基于植物的大麻素。在本发明中,术语“大麻素”可与“植物大麻素”互换使用。术语“大麻素谱(cannabinoid profile)”用于描述植物提取物中存在的大麻素、大麻素样物质或大麻素类化合物的组合。迄今为止,已在大麻植物中鉴定出100多种大麻素。ElSohly M.A.和Gul W.在《大麻手册》(Handbook of Cannabis,牛津大学出版社(2014),第3?22页)中全面、非限制性地列举了大麻中的此类大麻素。大麻素的一种优选但非限定性的实例是Δ9?四氢大麻酚(THC)。
本文提及的“THC”或“Δ9?四氢大麻酚”和“大麻二酚”或“CBD”或“大麻素”也应理解为包括此类化合物的药学上可接受的盐。术语“药学上可接受的盐(pharmaceutically acceptable salt)”是指由药学上可接受的无毒碱或酸制备的盐或酯,包括本领域技术人员熟知的无机碱或无机酸和有机碱或有机酸。本领域已知许多合适的无机碱和有机碱。
本文所用术语“萜烯(terpene)”或“萜类(terpenoid)”是指一类碳氢化合物分子(Radwan,M.M.等人Molecules 2021,26(9):2774)。萜烯的非限制性实例包含α?红没药醇、愈创醇和β?石竹烯。下文提供了萜烯的更多非限制性实例。萜类是在植物体内通常通过氧化过程进一步代谢的萜烯化合物,因此通常含有至少一个氧原子(Radwan,M.M.等人 Molecules 2021,26(9):2774)。术语“萜烯谱”用于描述植物提取物中存在的萜烯和萜类化合物的组合。
根据设想,本文所述方法可用于任何已知含有上述物质的植物材料来生产包含例如大麻素、萜烯和/或萜类的植物提取物。如上所述,优选的植物材料是大麻植物,优选为大麻植物的花部材料。
本文所述方法优选用于生产包含Δ9?四氢大麻酚(THC)的大麻植物提取物。
因此,本发明涉及一种从大麻植物中生产包含Δ9?四氢大麻酚(THC)的大麻植物提取物的方法,包含以下步骤:
(a)提供包含足量的Δ9?四氢大麻酚(THC)的大麻植物;
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用溶剂处理步骤(b)中的花部材料,并从花部材料中分离出含有Δ9?四氢大麻酚(THC)的大麻植物提取物。
本发明涉及一种从大麻植物中生产包含Δ9?四氢大麻酚(THC)的大麻植物提取物的方法,包含以下步骤:
(a)提供包含足量的Δ9?四氢大麻酚(THC)的大麻植物;
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用溶剂处理步骤(b)中的花部材料,并从花部材料中分离出含有Δ9?四氢大麻酚(THC)的大麻植物提取物;
其中,步骤(b)中定义的大麻植物花部材料的干燥步骤是在干燥室中进行的,通过将植物材料放在空气流动的托盘上,在20℃至35℃的温度范围内持续至少1天、2天、3天或4天,优选为4天。
本发明还涉及一种从大麻植物中生产包含Δ9?四氢大麻酚(THC)的大麻植物提取物的方法,包含以下步骤:
(a)提供包含足量的Δ9?四氢大麻酚(THC)的大麻植物;
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用溶剂处理步骤(b)中的花部材料,并从花部材料中分离出含有Δ9?四氢大麻酚(THC)的大麻植物提取物;
其中,步骤(b)中定义的大麻植物花部材料的干燥步骤是在干燥室中进行的,通过在20℃至35℃的温度范围内将植物材料放在空气流动的托盘上,直到花部材料的含水量少于10%。
测定含水量的方法可参阅《欧洲药典(2.2.32)》(European Pharmacopeia (2.2.32))和《德国大麻专著》(German monograph on Cannabis flos)。例如,可通过将1.0克粉末状药物在分子筛R上于40℃和1.5至2.5kPa压力下真空干燥24h来测定。
本文使用的术语“足量”是指植物(优选为大麻植物)的THC含量足够高,以便植物提取物(优选为通过本文所述方法使用所述植物或大麻植物生产的大麻植物提取物)具有所需的THC含量。换言之,本文所用的“足量”是指植物(优选为大麻植物)的THC浓度足够高,以便通过本文所述方法使用所述植物或大麻植物生产的植物提取物(优选为大麻植物提取物或大麻植物浸膏)具有所需的THC浓度。一般来说,本文所用的“足量”是指大麻植物的THC浓度按干重计至少为1%、2%、3%、4%、5%、6%、7%、9%、10%、20%或30%(w/w)。本文所说的干重是指植物材料不含水分。例如,若对含水量为10%的样品进行THC含量测量,测得该样品的THC浓度为20%,则按干重计,THC浓度为22.2%。
本领域技术人员熟知如何确定大麻植物或花部材料中的THC含量(例如,German Pharmacopeia 2018–Cannabisblüten/Cannabis flos,Announcement in the Federal Gazette:BAnz AT 24.04.2018B5)。
一般来说,在本文所述方法中使用THC浓度按干重计至少为1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、20%或30%(w/w)的大麻植物时,所获得/生产的大麻植物提取物(或如浓缩后的大麻植物浸膏)的THC浓度按大麻植物提取物重量计至少为60%,优选约70%至74%。如上所述,本领域技术人员熟知不同品种的大麻含有不同含量/浓度的大麻素(优选为THC)和/或其他(药用活性)物质(如萜烯)。因此,本领域技术人员可根据通过所述方法生产的大麻植物提取物中大麻素(优选为THC)和/或其他(药用活性)物质(如萜烯)的期望浓度,选择用于本文所述方法的大麻品种。当然,本领域技术人员还熟知,本文其他部分所述植物的不同部分具有不同浓度的例如大麻素(优选为THC)和/或其他(药用活性)物质(如萜烯)。例如,大麻植物中THC和/或其他(药用活性)物质(如萜烯)的浓度通常在花部材料中较高。
因此,对于本领域技术人员显而易见的是,当在本文所述方法中仅使用花部材料来生产大麻植物提取物时,花部材料中THC的浓度可能是相关的,并且本领域技术人员可以根据花部材料中THC的浓度而不是根据整个植物中的相应浓度来选择所使用的大麻品种。
本文所述方法中使用的植物(优选为大麻植物)中的例如大麻素(例如THC和/或CBD)和/或其他(药用活性)物质(例如萜烯)的浓度/含量可以按鲜重或干重(优选为干重)确定为例如大麻素(例如THC和/或CBD)和/或其他(药用活性)物质(例如萜烯)的百分比。因此,大麻植物中THC的浓度/含量可按THC的干重百分比来确定。大麻植物中THC的浓度/含量可按整株植物(即叶、花和茎)中THC的干重百分比来确定,也可仅按花部材料中THC的干重百分比来确定。
本文所述方法中使用的大麻植物花部材料中THC的浓度/含量按干重计可以至少13/31页为1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、20%或30%(w/w),优选按干重计至少为10%。对于本领域技术人员显而易见的是,本文使用的THC含量也可以指THC当量,即THC和THCA*0.877的总和。因此,在本发明中,术语“THC含量”涵盖THC和THCA含量。THC和THCA含量可通过本领域所述的液相色谱法测量(例如,German Pharmacopeia(DAB)2018,ISBN:978?3?7692?7217?8;Danish Medicines Standards 2020.0,BEK Nr.1231af25/11/2019;https://www.retsinformation.dk/eli/lta/2019/1231)。干重的定义是材料重量减去干燥失重(主要是水分)。
首先测定干燥失重。根据《欧洲药典(2.2.32)》(European Pharmacopeia (2.2.32)),干燥失重是指在特定条件下(如在烘箱中)干燥后的质量损失。干燥失重是对干燥过程中去除的水分(和其他挥发性化合物)的测量。
优选地,本文所述方法中使用的大麻植物包含按干重计含量至少为10%(w/w)的THC。
因此,本发明涉及一种从大麻植物中生产包含Δ9?四氢大麻酚(THC)的大麻植物提取物的方法,包含以下步骤:
(a)提供大麻植物,其包含按干重计含量至少为10%(w/w)的Δ9?四氢大麻酚(THC);
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用溶剂处理步骤(b)中的花部材料,并从花部材料中分离出含有Δ9?四氢大麻酚(THC)的大麻植物提取物。
在本发明的背景下,本文所述的任何特定大麻植物的THC含量可采用本领域熟知的方法进行定性和定量测定,如薄层色谱法(TLC)或高效液相色谱法(HPLC)。
在本文所述的方法中,大麻植物提取物是通过提取生产/获得的。可以使用任何提取方法,例如溶剂提取法、蒸馏法、压榨和升华法、煎煮法、消化法、渗滤法、索氏提取法(soxlethtation)、浸渍法或本领域技术人员已知的任何其他适当的提取方法及其组合。
本文优选溶剂提取法,即使用溶剂进行提取。可以设想将植物材料,优选为大麻植物材料与溶剂(也可称为提取剂)接触。换言之,就是用溶剂处理植物材料,优选为大麻植物材料。
根据设想,植物材料中的所需(药用活性)物质会溶解在溶剂中。因此,可以设想大麻植物材料中的大麻素(优选为THC)和/或其他(药用活性)物质(如萜烯)会溶解在溶剂中。这意味着用溶剂处理大麻植物材料后,大麻素(如THC和/或CBD)和/或其他(药用活性)物质(如萜烯)不再存在于大麻植物材料中,而是溶解在溶剂中。换言之,溶剂将大麻素(如THC和/或CBD)和/或其他(药用活性)物质(如萜烯)从植物材料中“去除”。换言之,大麻素(优选为THC)和/或其他(药用活性)物质(如萜烯)是从植物材料中提取出来的。溶解了大麻素(如THC和/或CBD)和/或其他(药用活性)物质(如萜烯类)的溶剂随后可以从植物材料中分离(即提取)出来。从植物材料(优选为大麻植物材料)中分离出的溶解了大麻素(如THC和/或CBD)和/或其他(药用活性)物质(如萜烯)的溶剂称为植物提取物,优选为大麻植物提取物。大麻植物提取物可按本文其他部分公开的方法进一步浓缩,然后可称为大麻植物浸膏。优选地,本文所述方法中使用的溶剂可从植物材料中去除THC。因此,本文所述方法可包含以下步骤:用溶剂处理步骤(b)中的(均质化)花部材料,并从花部材料和溶剂的混合物中分离出含有Δ9?四氢大麻酚(THC)的大麻植物提取物。本文所述方法中使用的溶剂还优选可以去除THC和萜烯。因此,优选本文所述方法中使用的溶剂能去除THC和一种或多种选自α?红没药醇、愈创醇和β?石竹烯的萜烯。
如上所述,在本文所述的方法中,可以用溶剂处理大麻植物材料。因此,本文所述方法可包含将(均质化)植物材料用溶剂覆盖,从而获得植物材料和溶剂的混合物。所述步骤在本文中称为“混合步骤”。
同样,本文所述方法可包含将大麻植物的花部材料用溶剂覆盖,从而获得大麻植物的花部材料与溶剂的混合物。具体地,本文所述方法的步骤(c)可包含将大麻植物的花部材料用溶剂覆盖,从而获得大麻植物的花部材料与溶剂的混合物。本领域技术人员容易确定植物材料与溶剂的合适比例。本文使用的植物材料与溶剂的比例为1:8.4(w/w),表示按重量计,溶剂的用量是植物材料的8.4倍。换言之,将1克植物材料用8.4克溶剂覆盖。本文所述方法中使用的大麻植物材料与溶剂的比例可作为非限制性实例为1:0.1(w/w)和1:100(w/w)之间的所有比例。优选地,本文所述方法中使用的大麻植物材料与溶剂的比例为1:1(w/w)至1:20(w/w)(即1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10、1:11、1:12、1:13、1:14、1:15、1:16、1:17、1:18、1:19或1:20(w/w)或其任意比例,例如1:14.7(w/w))。优选地,在本文所述方法中,以1:8.4(w/w)的比例将大麻植物材料用溶剂覆盖,从而得到大麻植物材料和溶剂的混合物。优选地,在本文所述方法中,以1:8.4(w/w)的比例将大麻植物的花部材料用溶剂覆盖,从而得到花部材料和溶剂的混合物。因此,优选本文所述方法的步骤(c)包含以1:8.4(w/w)的比例将花部材料用溶剂覆盖,从而得到花部材料与溶剂的混合物。
花部材料优选为完全被溶剂覆盖。
在获得植物材料(优选大麻植物材料,更优选大麻植物的花部材料)和溶剂的混合物后,本文所述方法可进一步把包含一个步骤,允许例如大麻素(优选THC)和/或其他(药用活性)物质(如萜烯)溶解在溶剂中。植物材料(优选为大麻植物材料,更优选大麻植物的花部材料)和溶剂的混合物可以进行孵育,允许例如大麻素(优选为THC)和/或其他(药用活性)物质(如萜烯)溶解在溶剂中。所述孵育步骤优选为浸渍(有时也称为静态提取)。
所述步骤在本文中称为“浸渍步骤(maceration step)”。
浸渍可持续几分钟、几小时、几天或几周,优选为几小时至几天。因此,浸渍时间可为1h至48h(即,1h、2h、3h、4h、5h、6h、7h、8h、9h、10h、11h、12h、13h、14h、15h、16h、17h、18h、19h、20h、21h、22h、23h、24h、25h、26h、27h、28h、29h、30h、31h、32h、33h、34h、35h、36h、37h、38h、39h、40h、41h、42h、43h、44h、45h、46h或47h、48h,优选为24±1小时(h))。
所述浸渍可在4℃至50℃的温度下进行,优选在15℃至25℃(即15℃、16℃、17℃、18℃、19℃、20℃、21℃、22℃、23℃、24℃、25℃)的温度下进行。
浸渍优选在避光条件下进行。
因此,本文所述方法的步骤(c)可包含在15℃至25℃的温度下浸渍约24h。本文所用的与时间有关的术语“约”是指比标示值多10%或少10%。
优选地,本文所述方法的步骤(c)可包含在15℃至25℃的温度和避光条件下浸渍24±1h。
本文进一步设想,在通过例如浸渍将植物材料(优选为大麻植物材料,更优选大麻植物的花部材料)和溶剂的混合物进行孵育后,再次添加溶剂。换言之,本文设想在“浸渍步骤”之后再添加溶剂。因此,本文所述方法的步骤(c)包含向植物材料(优选大麻植物材料,更优选大麻植物的花部材料)和溶剂的混合物中再次添加更溶剂。所述步骤在本文中称为“再次添加溶剂步骤”。可以添加相同或不同的溶剂。优选地,向混合物中添加相同的溶剂。可添加任意量的溶剂,使得在再次添加溶剂后,大麻植物材料与溶剂的比例为1:1(w/w)至1:20(w/w)(即,1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10、1:11、1:12、1:13、1:14、1:15、1:16、1:17、1:18、1:19或1:20(w/w)或其任意比例,例如1:14.7(w/w))。优选地,添加一定量的溶剂,使得溶剂量加倍,即在再次添加溶剂之前,大麻植物材料与溶剂的比例为1:8.4(w/w),以及再次添加溶剂后,大麻植物材料与溶剂的比例约为1:16.8(w/w)。
优选地,在再次添加溶剂后,植物材料(优选大麻植物材料,更优选大麻植物的花部材料)和溶剂的比例约为1:16.8(w/w)。本文所用的术语“约”是指比标示值多10%或少10%。
因此,本文所述方法的步骤(c)可包含再次添加溶剂,使花部材料和溶剂在花部材料和溶剂混合物中的比例约为1:16.8(w/w)。
换言之,本文所述方法的步骤(c)可包含再次添加溶剂,从而得到花部材料和溶剂比例约为1:16.8(w/w)的混合物。
一般来说,本领域技术人员知晓如何确定适当的植物材料与溶剂的比例。例如,如果使用磨碎或粉碎的植物或花部材料,材料的体积密度会更高,所需的提取溶剂也会更少。
优选地,在再次添加溶剂后进行渗滤。所述步骤在本文中称为“渗滤步骤(percolation step)”。“浸渍步骤”可以在渗滤器中进行。如果“浸渍步骤”不是在渗滤器中进行,则在“渗滤步骤”之前将花部材料和溶剂的混合物转移到渗滤器中。
随后让溶剂流过花部材料。换言之,溶剂渗入花部材料。流速范围为每千克花部材料1.0ml/min至10.0ml/min,优选为每千克花部材料3.55ml/min至5.45ml/min,更优选为每千克花部材料4.0ml/min至5.0ml/min(即每千克花部材料4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9或5.0ml/min),最优选为每千克花部材料4.0ml/min。溶剂可被泵送并多次流经花部材料。优选花部材料不断被溶剂覆盖。渗滤持续进行,直至回收渗滤物。渗滤可进行1至400h,优选为63至97小时(即63h、64h、65h、66h、67h、68h、69h、70h、71h、72h、73h、74h、75h、76h、77h、78h、79h、80h、81h、82h、83h、84h、85h、86h、87h、88h、89h、90h、91h、92h、93h、94h、95h、96h或97h),最优选86小时(h)。渗滤物(percolate)是含有从大麻花部材料中提取的物质的溶剂,即含有溶解的例如大麻素(优选为THC)和/或其他(药用活性)物质(如萜烯)的溶剂。含有溶解的例如大麻素(优选为THC)和/或其他(药用活性)物质(如萜烯类)的溶剂也被称为油水混合物(miscella)。
从渗滤器中回收的溶解有THC的溶剂可为大麻植物提取物。所述大麻植物提取物可以进一步浓缩,随后可称为大麻植物浸膏。然而,从渗滤器中回收的含有溶解THC的溶剂还可以进行下文所述的其他提纯和/或分离步骤。
有关渗滤的更多信息请参阅《欧洲药典》(European pharmacopeia(04/2019:0765))。
根据设想,在“浸渍步骤”和“渗滤步骤”中,大麻花部材料中的大麻素(优选为THC)和/或其他(药用活性)物质(如萜烯、萜类(芳香物质)、其他次生花部物质如叶绿素和类黄酮)会溶解在溶剂中。换言之,在“浸渍步骤”和“渗滤步骤”中,THC从大麻花部材料中提取出来。
因此,干燥的大麻花部材料的提取可按以下步骤进行:
仅在干燥步骤之前修剪的干燥花部的Δ9?THC当量(Δ9?THC+Δ9?THCA*0.877)的最低含量按干重计必须为10%(即按干重计至少为10%(w/w))。每千克干干燥的大麻花部材料使用16.7kg(15.9kg至17.5kg)的96%(v/v)药用级乙醇。提取过程是在15℃至25℃的温度下,在底部装有滤网(strainer)的圆柱形不锈钢药用级提取容器中进行的。提取过程分为浸渍(静态提取)和渗滤(流动提取)。在浸渍过程中,首先用一半量的乙醇(每千克花8.35kg±5%)浸泡干燥的大麻花部材料24h±1h,这样可以溶解大部分Δ9?THC和其他大麻素以及相关的次生植物物质,如萜烯(芳香物质)、脂肪和叶绿素。浸渍后,向油水混合物(即溶解有大麻素(如THC和/或CBD)和/或其他(药用活性)物质(如萜烯)的溶剂)中加入另一半量的乙醇,并开始渗滤。这样,油水混合物以每千克新鲜花部材料4.0至5.0ml/min的流速渗入新鲜花部材料中,持续63至97h,并通过提取容器中的滤网收集到由药用不锈钢制成的移动缓冲罐中。花部材料铺在滤网上,提取物流入缓冲罐的开口位于滤网下方。此外,提取物在进入缓冲罐/收集罐的过程中还会通过一个药用级过滤器泵送。所收集的油水混合物(即溶解有例如大麻素(如THC和/或CBD)和/或其他(药用活性)物质(如萜烯)的溶剂)可为大麻植物提取物,但通常没有达到所需的THC浓度。因此优选对油水混合物进行进一步浓缩和/或纯化和/或分离步骤,随后可称为大麻植物浸膏。
本文所述方法还可包括一个步骤,在该步骤中,溶解有例如大麻素(优选为THC)和/或其他(药用活性)物质(如萜烯)的溶剂从(大麻花部)植物材料中分离出来。所述步骤在本文中称为“分离步骤”。当含有溶解的THC的溶剂从大麻植物材料中分离出来时,所述溶剂被称为大麻植物提取物。因此,在“分离步骤”中,(大麻)植物提取物从植物材料(优选为大麻植物材料,更优选大麻植物的花部材料)和溶剂的混合物中分离出来。因此,本文所述方法的步骤(c)可包括将(大麻)植物提取物从植物材料(优选大麻植物材料,更优选大麻植物的花部材料)和溶剂的混合物中分离出来。
换言之,本文所述方法的步骤(c)可以包括从花部材料中分离出大麻植物提取物(优选包含Δ9?四氢大麻酚(THC))。
在“分离步骤”中,本领域技术人员可以采用离心、过滤、倾析和蒸馏等所有合适的方法来分离液体和固体物质。
如上所述,在进行渗滤时,渗滤器可包含滤网,用于将大麻花部材料从溶剂中分离出来。然而,渗滤器的滤网可能只能去除较大部分的大麻花部材料,因此还需要额外的净化和/或分离步骤。额外的净化和/或分离步骤可为过滤(filtration)。
优选地,溶解有THC的溶剂通过药用级聚丙烯颗粒过滤器(filter)进一步过滤纯化,沉积率为1.5μm。优选地,操作压力和温度尽可能分别不超过5bar和50℃。对于本文所述的所有方法,本领域技术人员都可以通过标准技术测量温度和压力等参数。过滤可以在移动缓冲罐的渗滤和收集之间进行,或者之后将过滤后的混合物收集到第二个相同不锈钢等级的移动缓冲罐中。
在本发明的背景下,从大麻植物中生产包含Δ9?四氢大麻酚(THC)的大麻植物提取物的优选方法包含以下步骤:
(a)提供包含足量的Δ9?四氢大麻酚(THC)的大麻植物;
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用溶剂处理步骤(b)中的花部材料,并从花部材料中分离出含有Δ9?四氢大麻酚(THC)的大麻植物提取物。
其中,步骤(c)中定义的处理步骤包含以下步骤:
(i)以约1:8.4(w/w)的比例将花部材料用溶剂覆盖,从而得到花部材料与溶剂的混合物;
(ii)在15℃至25℃的温度和避光条件下浸渍约24h;
(iii)再次添加溶剂,从而得到花部材料和溶剂比例约为1:16.8(w/w)的混合物;
(iv)进行渗滤,其中在15℃至25℃的温度和避光条件下,溶剂以每千克花部材料3.55至5.45ml/min、优选为每千克花部材料4.0ml/min的流速渗入花部材料中,持续63至97h,优选为86h;以及
(v)从大麻花部材料中分离出大麻植物提取物。
本发明还涉及一种从大麻植物中生产包含Δ9?四氢大麻酚(THC)的大麻植物提取物的方法,包含以下步骤:
(a)提供大麻植物,其包含按干重计至少10%的Δ9?四氢大麻酚(THC);
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用溶剂处理步骤(b)中的花部材料,并从花部材料中分离出含有Δ9?四氢大麻酚(THC)的大麻植物提取物;
其中,步骤(c)中定义的处理步骤包含以下步骤:
(i)以约1:8.4(w/w)的比例将花部材料用溶剂覆盖,从而得到花部材料与溶剂的混合物;
(ii)在15℃至25℃的温度和避光条件下浸渍约24h;
(iii)再次添加溶剂,从而得到花部材料和溶剂比例约为1:16.8(w/w)的混合物;
(iv)进行渗滤,其中在15℃至25℃的温度和避光条件下,溶剂以每千克花部材料3.55至5.45ml/min、优选为每千克花部材料4.0ml/min的流速渗入花部材料中,持续63至97h,优选为86h;以及
(v)从大麻花部材料中分离出大麻植物提取物。
本发明还涉及一种从大麻植物中生产包含Δ9?四氢大麻酚(THC)的大麻植物提取物的方法,包含以下步骤:
(a)提供一株大麻品种为DKJ127的大麻植物;
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用溶剂处理步骤(b)中的花部材料,并从花部材料中分离出含有Δ9?四氢大麻酚(THC)的大麻植物提取物。
可以测定本文所述方法中使用的大麻植物(优选为品种DKJ127)中的THC浓度/含量,以评估THC浓度/含量是否足够,例如通过本文所述方法生产的大麻植物提取物是否具有所需的THC浓度/含量。
因此,本发明还涉及一种从大麻植物中生产包含Δ9?四氢大麻酚(THC)的大麻植物提取物的方法,包含以下步骤:
(a)提供一株大麻品种为DKJ127的大麻植物,其包含足量的Δ9?四氢大麻酚(THC);
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用溶剂处理步骤(b)中的花部材料,并从花部材料中分离出包含Δ9?四氢大麻酚(THC)的大麻植物提取物。
在本发明的上下文中,从大麻植物中生产包含Δ9?四氢大麻酚(THC)的大麻植物提取物的优选方法包含以下步骤:
(a)提供一株大麻品种为DKJ127的大麻植物;
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用溶剂处理步骤(b)中的花部材料,并从花部材料中分离出包含Δ9?四氢大麻酚(THC)的大麻植物提取物;
其中,步骤(c)中定义的处理步骤包含以下步骤:
(i)以约1:8.4(w/w)的比例将花部材料用溶剂覆盖,从而得到花部材料与溶剂的混合物;
(ii)在15℃至25℃的温度和避光条件下浸渍约24h;
(iii)再次添加溶剂,从而得到花部材料和溶剂比例约为1:16.8(w/w)的混合物;
(iv)进行渗滤,其中在15℃至25℃的温度和避光条件下,溶剂以每千克花部材料3.55至5.45ml/min、优选为每千克花部材料4.0ml/min的流速渗入花部材料中,持续63至97h,优选为86h;以及
(v)从大麻花部材料中分离出大麻植物提取物。
如上所述,溶剂用于从植物材料(优选为大麻植物材料)中分离所需物质(如大麻素(如THC和/或CBD)和/或其他(药用活性)物质(如萜烯))。任何溶剂都可以使用,只要该溶剂能够从植物材料中“去除”所需物质即可。换言之,所需物质应能溶解或可溶于所用的溶剂中。
适用的溶剂的非限制性实例包括醇类(如甲醇、乙醇、丙醇、丁醇、丙二醇等)、水、烃类(如丁烷、己烷等)、极性有机溶剂(如乙酸乙酯、聚乙二醇等)或超临界流体(如液态CO2)及其水溶液。
适用的非极性溶剂可为C5?C12直链或支链烷烃、C1?C12醇或C1?C12醇的碳酸酯。挥发性较强的溶剂可能特别有用,因为若有需要,它们更容易从提取物中去除。尽管对于本领域技术人员是显而易见的,但需注意,上述溶剂的混合物也可用于本文所述的方法。用于本文所述方法的优选溶剂是乙醇、丁醇、烷烃(如戊烷、庚烷和丙烷)、乙醚、叔丁基甲基醚、甲基乙基酮、丙酮、乙酸乙酯、CO2。本发明所述方法的优选溶剂是乙醇,特别是96Vol?%的乙醇。在本发明的背景下,优选使用药用级溶剂。
因此,本发明涉及一种从大麻植物中生产包含Δ9?四氢大麻酚(THC)的大麻植物提取物的方法,包含以下步骤:
(a)提供包含足量的Δ9?四氢大麻酚(THC)的大麻植物;
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用乙醇处理步骤(b)中的花部材料,并从花部材料中分离出含有Δ9?四氢大麻酚(THC)的大麻植物提取物。
在本发明的背景下,从大麻植物中生产包含Δ9?四氢大麻酚(THC)的大麻植物提取物的优选方法包含以下步骤:
(a)提供包含足量的Δ9?四氢大麻酚(THC)的大麻植物;
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用乙醇处理步骤(b)中的花部材料,并从花部材料中分离出含有Δ9?四氢大麻酚(THC)的大麻植物提取物;
其中,步骤(c)中定义的处理步骤包含以下步骤:
(i)以约1:8.4(w/w)的比例将花部材料用乙醇覆盖,从而得到花部材料与乙醇的混合物;
(ii)在15℃至25℃的温度和避光条件下浸渍约24h;
(iii)再次添加乙醇,从而得到花部材料和乙醇比例约为1:16.8(w/w)的混合物;
(iv)进行渗滤,其中在15℃至25℃的温度和避光条件下,乙醇以每千克花部材料3.55至5.45ml/min、优选为每千克花部材料4.0ml/min的流速渗入花部材料中,持续63至97h,优选为86h;以及
(v)从大麻花部材料中分离出大麻植物提取物。
在本发明的背景下,从大麻植物中提取包含Δ9?四氢大麻酚(THC)的大麻植物提取物的一种特别优选方法包含以下步骤:
(a)提供一株大麻品种为DKJ127的大麻植物;
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用乙醇处理步骤(b)中的花部材料,并从花部材料中分离出包含Δ9?四氢大麻酚(THC)的大麻植物提取物;
其中,步骤(c)中定义的处理步骤包含以下步骤:
(i)以约1:8.4(w/w)的比例将花部材料用乙醇覆盖,从而得到花部材料与乙醇的混合物;
(ii)在15℃至25℃的温度和避光条件下浸渍约24h;
(iii)再次添加乙醇,从而得到花部材料和乙醇比例约为1:16.8(w/w)的混合物;
(iv)进行渗滤,其中在15℃至25℃的温度和避光条件下,乙醇以每千克花部材料3.55至5.45ml/min、优选为每千克花部材料4.0ml/min的流速渗入花部材料中,持续63至97h,优选为86h;以及
(v)从大麻花部材料中分离出大麻植物提取物。
本文还设想通过浓缩步骤,进一步浓缩根据本文所述方法生产的大麻植物提取物。本文“浓缩步骤”是指从液态大麻植物提取物中去除溶剂。溶剂可通过蒸发或冷冻干燥的方式去除。然而,浓缩步骤(如蒸发步骤)也可为根据本发明和本文所述的方法的一部分。因此,本文所述的方法还可包括从液态大麻植物提取物中蒸发溶剂以浓缩提取物。此外,脱羧步骤也可为本发明方法的一部分。根据设想,经过浓缩步骤和/或脱羧步骤后的大麻植物提取物可称为大麻植物浸膏。
因此,本发明涉及一种从大麻植物中生产包含Δ9?四氢大麻酚(THC)的大麻植物提取物的方法,包含以下步骤:
(c)用溶剂处理步骤(b)中的花部材料,并从花部材料中分离出包含Δ9?四氢大麻酚(THC)的大麻植物提取物;
其中,该方法还包括从液态大麻植物提取物中蒸发溶剂以浓缩提取物。
优选地,使用旋转蒸发仪(例如,制造商:Büchi;型号:Rotavapor R?220Pro;蒸馏速率:高达12L乙醇/h;烧瓶尺寸:20L;烧瓶最大容量:12L;连续进样)在真空中蒸发大麻植物提取物中的溶剂。
水浴温度、压力和转速可分别为约72℃(即67℃、68℃、69℃、70℃、71℃、72℃、73℃、74℃、75℃、76℃、77℃或其一部分);约185mbar(即175mbar、176mbar、177mbar、178mbar、179mbar、180mbar、181mbar、182mbar、183mbar、184mbar、185mbar、186mbar、187mbar、188mbar、189mbar、190mbar、191mbar、192mbar、193mbar、194mbar、195mbar或其一部分);以及约150r/min(即145rpm、146rpm、147rpm、148rpm、149rpm、150rpm、151rpm、152rpm、153rpm、154rpm、155rpm、156rpm、157rpm、158rpm、159rpm或160rpm)。这些条件导致乙醇的蒸汽温度为41℃?42℃,蒸发性能(evaporation performance)约为10L/h。当蒸汽温度降到30℃以下时,蒸发过程结束,表明乙醇几乎被完全去除。使用多台旋转蒸发仪同时蒸发溶剂,总蒸发时间可以保持恒定,与批次大小无关。获得一种几乎无溶剂的大麻植物提取物,呈深绿色至深棕色树脂状,主要由Δ9?THCA和部分活化的Δ9?THC组成。
在大麻植物中,THC主要以四氢大麻酚酸(THCA)的形式存在。因此,将根据本文所述方法生产的大麻植物提取物中的四氢大麻酚酸可转化为Δ9?四氢大麻酚(THC)可能是有益的或满足需求。将四氢大麻酚酸(THCA)转化为Δ9?四氢大麻酚(THC)是一种脱羧反应。脱羧是一种释放二氧化碳的化学反应。转化步骤(即脱羧步骤)也是本发明和本文所述的方法的一部分。因此,本文所述的方法还可包含将大麻植物提取物加热到一定温度,将四氢大麻酚酸(THCA)脱羧为Δ9?四氢大麻酚(THC)。
为了将四氢大麻酚酸(THCA)脱羧成Δ9?四氢大麻酚(THC),可将大麻植物提取物加热至50℃至150℃,优选为约80℃(即75℃、76℃、77℃、78℃、79℃、80℃、81℃、82℃、83℃、84℃、85℃或其任意部分)。优选地,脱羧反应在真空条件下进行。真空度优选约为185mbar(即175mbar、176mbar、177mbar、178mbar、179mbar、180mbar、181mbar、182mbar、183mbar、184mbar、185mbar、186mbar、187mbar、188mbar、189mbar、190mbar、191mbar、192mbar、193mbar、194mbar、195mbar或其一部分)。脱羧可进行约72h(即67h、68h、69h、70h、71h、72h、73h、74h、75h、76h、77h或其任何部分)。
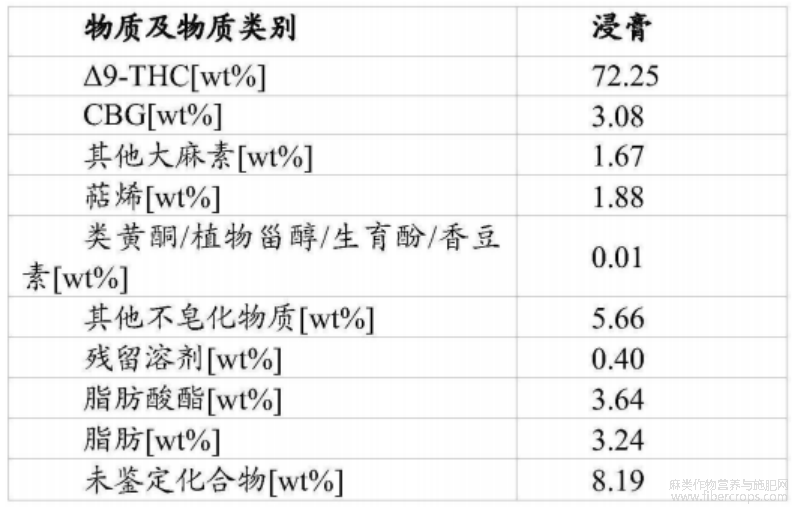
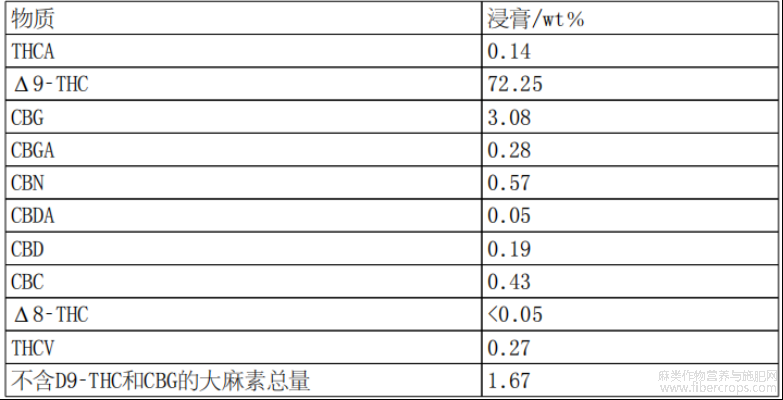
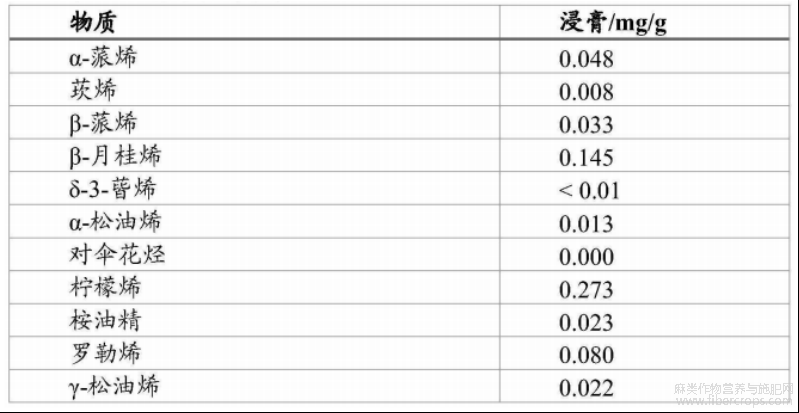
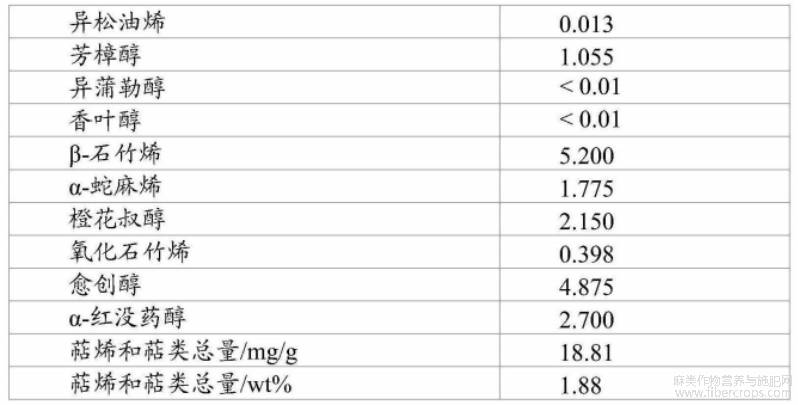
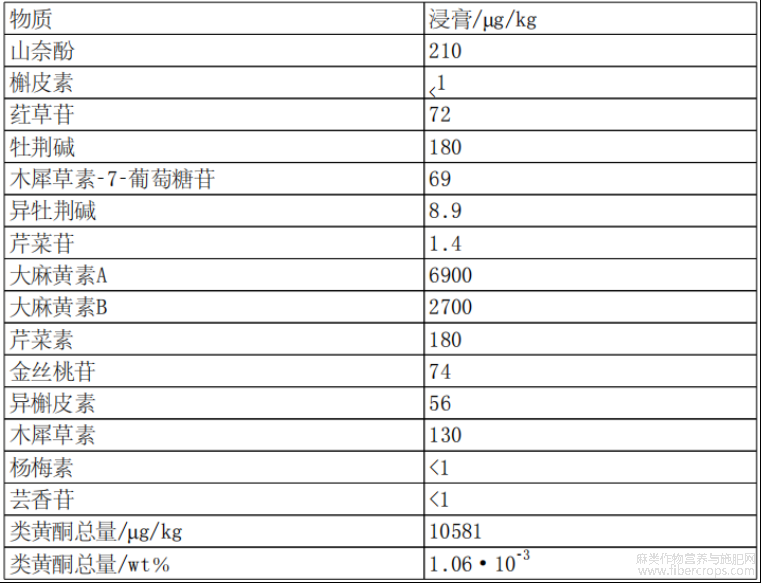
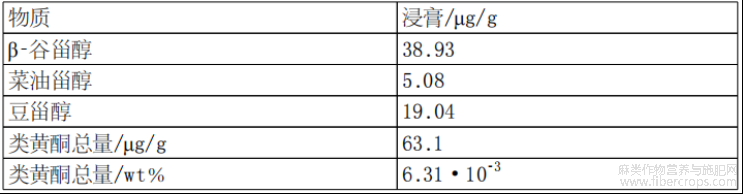
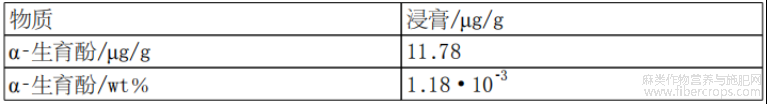
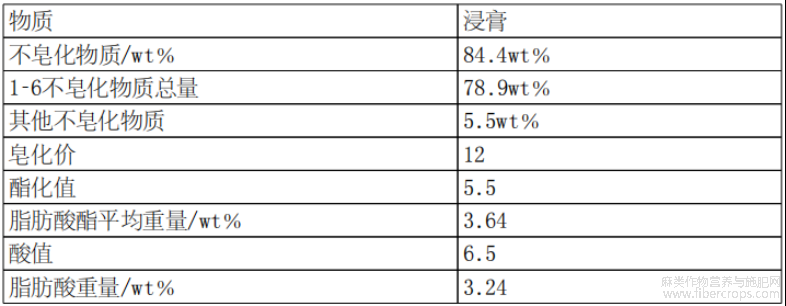
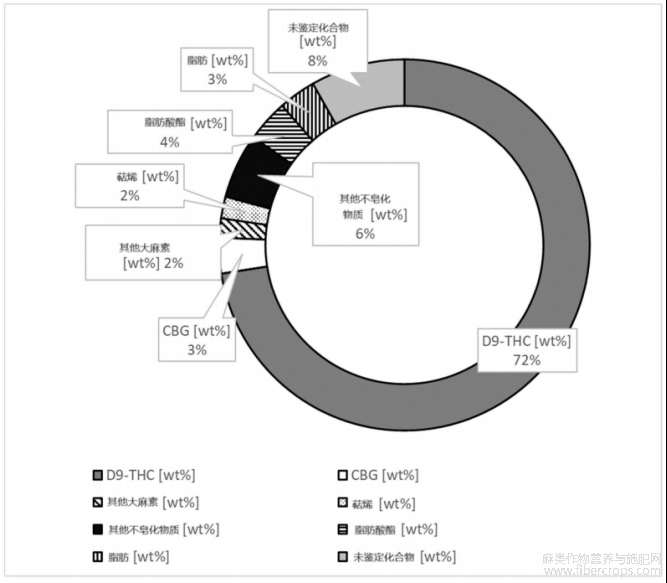
根据设想,经过浓缩步骤和脱羧步骤后的大麻植物提取物可称为大麻植物浸膏,其成分如图1和表1至表7所示。
表1浸膏表征概述
表2浸膏中大麻素概述
表3浸膏中萜烯和萜类概述
表4浸膏中类黄酮概述
表5浸膏中植物甾醇概述
表6浸膏中α?生育酚概述
表7浸膏中不皂化物质和皂化物质概述
因此,本发明涉及一种从大麻植物中生产包含Δ9?四氢大麻酚(THC)的大麻植物提取物的方法,包含以下步骤:
(a)提供包含足量的Δ9?四氢大麻酚(THC)的大麻植物;
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用溶剂处理步骤(b)中的花部材料,并从花部材料中分离出含有Δ9?四氢大麻酚(THC)的大麻植物提取物;
其中,该方法还包含在约185mbar的真空条件下将大麻植物提取物加热至约80℃的温度,使四氢大麻酚酸(THCA)脱羧成Δ9?四氢大麻酚(THC)。
根据设想,大麻植物提取物中至少有90%至100%的THCA脱羧成THC(即90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%,或其中的任何部分,如95.7%)。
优选地,通过真空热诱导脱羧将Δ9?THCA完全转化为Δ9?THC。因此,使用旋转蒸发仪将水浴温度、压力和转速分别调至80℃、185mbar和150r/min。脱羧时间可为72h。所得到的大麻植物提取物呈深绿色至深棕色树脂状,THC的平均含量约为70至74wt.%。干燥花部和浸膏之间的转换系数平均为4.7。4.7的转换系数意味着25kg的大麻花通过本文所述的方法提取后,可以得到大约5.3kg的大麻植物浸膏。
本文还设想,根据本发明的方法还包括从液态大麻植物提取物中蒸发溶剂以浓缩提取物,并将大麻植物提取物加热到一定温度,使四氢大麻酚酸(THCA)脱羧成为Δ9?四氢大麻酚(THC)。
因此,本发明涉及一种从大麻植物中生产包含Δ9?四氢大麻酚(THC)的大麻植物提取物(浸膏)的方法,包含以下步骤:
(a)提供包含足量的Δ9?四氢大麻酚(THC)的大麻植物;
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;
(c)用溶剂处理步骤(b)中的花部材料,并从花部材料中分离出含有Δ9?四氢大麻酚(THC)的大麻植物提取物;
(d)从液态大麻植物提取物中蒸发溶剂以浓缩提取物;以及
(e)在约185mbar的真空条件下,将大麻植物提取物加热到约80℃的温度,使四氢大麻酚酸(THCA)脱羧成Δ9?四氢大麻酚(THC)。
如上所述,本文所述方法无需冬化步骤。因此,可以设想在不进行冬化步骤的情况下进行本文所述方法。本文“冬化步骤”或“冬化”是指降低大麻植物提取物温度以特别去除蜡的方法步骤。冬化通常是在大麻植物提取物例如通过蒸发浓缩后进行。通常在冬化过程中,温度会降到10℃以下,优选为0℃下,如?5、?10、?20或?25℃。然后通常将大麻植物提取物在低温下孵育例如48h。孵育步骤后,通过例如离心或过滤等方法去除沉淀物。通常在降低大麻植物提取物的温度之前,会将所述提取物与(额外的)有机溶剂(如甲醇或乙醇)混合。冬化方法在DE 103 37 458A1和WO 2002/064109A2中均有描述。
因此,本发明涉及一种从大麻植物中生产包含Δ9?四氢大麻酚(THC)的大麻植物提取物(浸膏)的方法,其中该方法不包括冬化步骤。短语“其中该方法不包括冬化步骤”和“不涉及冬化步骤”与不“不进行冬化步骤”同义使用。因此,本发明涉及一种从大麻植物中生产包含Δ9?四氢大麻酚(THC)的大麻植物提取物(浸膏)的方法,其中不进行冬化步骤。
因此,本发明涉及一种从大麻植物中生产包含Δ9?四氢大麻酚(THC)的大麻植物提取物的方法,包含以下步骤:
(a)提供包含足量的Δ9?四氢大麻酚(THC)的大麻植物;
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用溶剂处理步骤(b)中的花部材料,并从花部材料中分离出包含Δ9?四氢大麻酚(THC)的大麻植物提取物,
其中,该方法不涉及冬化步骤。
本发明还涉及一种生产大麻植物提取物的方法,包含以下步骤:
(a)提供一株大麻植物,优选地其包含足量的Δ9?四氢大麻酚(THC)的植物;
(b)将从剩余植物材料中分离出来的花部材料修剪并干燥;以及
(c)用溶剂处理步骤(b)中的花部材料,并从花部材料和溶剂的混合物中分离出大麻植物提取物;
其中,步骤(c)中定义的处理步骤包含以下步骤:
(i)以约1:8.4(w/w)的比例将花部材料用溶剂覆盖,从而得到花部材料与溶剂的混合物;
(ii)在15℃至25℃的温度和避光条件下浸渍约24h;
(iii)再次添加溶剂,从而得到花部材料和溶剂比例约为1:16.8(w/w)的混合物;
(iv)进行渗滤,其中在15℃至25℃的温度和避光条件下,溶剂以每千克花部材料3.55至5.45ml/min、优选为每千克花部材料4.0ml/min的流速渗入花部材料中,持续63至97h,优选为86h;以及
(v)从大麻花部材料中分离出大麻植物提取物,
其中,该方法不涉及冬化步骤。
本发明还涉及通过本文公开的方法和工艺生产/获得的植物提取物。因此,本发明还涉及通过本文所述方法生产/获得的大麻植物提取物。因此,本发明还涉及通过本文所述方法生产/获得的包含Δ9?四氢大麻酚(THC)的大麻植物提取物。
因此,本发明涉及一种可通过本文所述方法获得的包含Δ9?四氢大麻酚(THC)的大麻植物提取物。所述大麻植物提取物可为液体形式。因此,本发明涉及一种,可通过本文所述方法获得的包含Δ9?四氢大麻酚(THC)的液态大麻植物提取物。如本文其他部分所述,可通过本文所述方法获得的包含Δ9?四氢大麻酚(THC)的大麻植物提取物可为无溶剂和脱羧的形式。因此,本发明涉及一种包含Δ9?四氢大麻酚(THC)的大麻植物提取物,可通过本文所述方法以无溶剂和脱羧形式获得。
本发明还涉及一种可通过本文所述方法获得的大麻植物提取物,其包含按重量计约占大麻植物提取物70%至74%的Δ9?四氢大麻酚(THC)。在THC含量方面使用的术语“约”是指比标示值多20%或少20%。在本发明的背景下,本文所述的任何特定大麻植物的THC含量可采用本领域技术人员熟知的方法进行定性和定量测定,如薄层色谱法(TLC)或高效液相色谱法(HPLC)。
在本发明的背景下,大麻植物提取物,优选为通过本文所述方法生产/获得的大麻植物浸膏,可以如图1和表1至表7所示进行复合。
根据设想,通过本文所述方法获得的大麻植物提取物或大麻植物浸膏可进一步加工成包含所需的大麻植物物质(如Δ9?四氢大麻酚(THC)和/或萜烯)的组合物。然而,还可设想,将通过本文所述方法获得的大麻植物提取物直接用于(即无需进一步加工)例如药物或制剂。未经进一步加工的大麻植物提取物可称为原生提取物。因此,本文中使用的术语“一种包含所需的大麻植物物质(如通过本文所述方法获得的Δ9?四氢大麻酚(THC)和/或萜烯)的组合物”可以指通过本文所述方法获得的大麻植物提取物,但也可以指通过本文所述方法获得的经过进一步加工的大麻植物提取物。因此,“一种通过本文所述方法获得的组合物”与“一种通过本文所述方法获得的大麻植物提取物(浸膏)”同义使用。换言之,本文设想将通过本文所述方法获得的大麻植物提取物直接用于药物制剂,即直接配制成药物或制剂,或者首先将通过本文所述方法获得的大麻植物提取物进一步加工成组合物,然后将所述组合物用于药物制剂。将通过本文所述方法获得的大麻植物提取物加工成组合物可能是必要的,以便例如储存和/或运输所述大麻植物提取物。
大麻植物提取物可以通过改变pH值或以优选浓度添加一种或多种溶剂等方式进行加工,但不限于此。在某些情况下,还可以本文所述的提取物例如通过滤纸或具有适合过滤的孔径的细筛进行过滤去除颗粒物质。因此,本发明的组合物优选以液体形式提供。正如所理解的,一种或多种额外的化合物(如大麻素、萜烯或萜类化合物)可以添加到本文所述的组合物中。添加化合物可能是为了补偿提供提取物的大麻植物所表达的某些化合物相对量的自然变化。添加的化合物可为所需化合物的天然或合成版本。
然而,也可以设想将通过本文所述方法获得的大麻植物提取物本身,即原生提取物用作药物制剂。
因此,本文公开的针对组合物和药物制剂的所有内容也适用于大麻植物提取物或大麻植物浸膏,反之亦然。对于本领域技术人员显而易见的是,当本文提及“大麻植物提取物(浸膏)”时,也是指“通过本文所述方法获得的大麻植物提取物(浸膏)”。
通过本文所述方法获得的大麻植物提取物或大麻植物浸膏可通过本领域已知的方法进行分析。
可通过目视检查来确定大麻植物浸膏颜色为黄色至绿色。
可根据《欧洲药典2.2.27》(Ph.Eur.2.2.27)并根据DAB专著“Eingestellter Cannabisextrakt”,通过TLC进一步分析该提取物。还可以根据《欧洲药典2.2.29》(Ph.Eur.2.2.29)并基于DAB专著“Eingestellter Cannabisextrakt”的内部验证方法,通过比较大麻素谱与参考标准的保留时间以及本产品的参考色谱图,使用高效液相色谱(HPLC)分析进一步分析该提取物。
可根据《欧洲药典2.2.28》(Ph.Eur.2.2.28)和经内部验证的GC?MS方法,通过比较萜烯/萜类谱与参考标准的保留时间和本产品的参考色谱图进一步分析该提取物。
含水量可根据《欧洲药典2.5.12》(Ph.Eur.2.5.12)(Karl Fischer)来测定,且乙醇含量可根据《欧洲药典》(Ph.Eur.2.2.28)和经内部验证的GC方法进行分析。微生物杂质可根据《欧洲药典5.1.4?2》(Ph.Eur.5.1.4?2)包括《欧洲药典2.6.12和2.6.31》(Ph.Eur.2.6.12and 2.6.31)进行分析。
通过本文所述方法获得的大麻植物提取物或大麻植物浸膏可进行如下的蜡分析:
将1.00kg浸膏与1.75kg乙醇混合并搅拌30分钟。所得到的溶液可以用71μm的金属筛网过滤,然后加入乙醇,得到浸膏与乙醇的比例为1:2.3的浸膏?乙醇溶液。将溶液放入冰箱冷冻48h(冬化)。48h后,顶部可能没有明显的脂肪层,只能看到一些小的不透明斑块/条纹。可使用50μm和第二个21μm金属筛网进行过滤。可收集深色脂肪物质。可将收集到的深色脂肪物质溶于约30ml乙醇中并离心。当获得例如20克蜡时,大麻植物提取物中的蜡含量约为2%。
根据本文所述方法可获得的大麻植物提取物优选地基本上不含或含有少量蜡和其他非特异性脂溶性物质,但优选地含有大麻植物中天然存在的基本上所有大麻素,最优选地是与它们在整株大麻植物中的比例基本相同。换言之,根据本文所述方法获得的大麻植物提取物优选地基本上不含皂化物质或皂化物质含量较低。本文使用的可皂化物质可指脂类,包括游离脂肪酸、甘油三酯和蜡(单酯化脂肪酸)。根据本文所述方法获得的大麻植物提取物优选包含按重量计少于10%、9%、8%、7%、6%、5%、4%、3%、2%或1%的可皂化物质,最优选包含按重量计少于8%的可皂化物质。根据本文所述方法获得的大麻植物提取物或大麻植物浸膏中优选包含按重量计少于3%、2.1%或2%的蜡。
如上所述,根据本文所述方法获得的大麻植物提取物优选包含THC。
因此,可以设想组合物(即大麻植物提取物或大麻植物浸膏)包含作为主要大麻素的THC,然而,不排除可选地存在其他大麻素,包括但不限于大麻二酚(CBD)、D?8?四氢大麻酚(Δ8?THC)、大麻二酚酸(CBDA)、大麻色烯(CBC)、四氢大麻酚酸(THCA)、四氢大麻素(THCV)、次大麻二酚(CBDV)、大麻酚(CBN)、大麻萜酚酸(CBGA)和大麻萜酚(CBG)。具体而言,可以理解的是,包含THC作为主要大麻素的本发明组合物可能包含少量的CBD,例如,按组合物重量计,CBD含量少于10%,或按组合物重量计,CBD含量少于9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.2%或0.1%,或者可能不包含任何可测量的CBD。在本发明中,优选的是按组合物重量计,组合物包含少于0.5%的CBD、少于约3.1%的CBG和少于约2.5%、2.2%、2.1%、2.0%、1.9%、1.8%、1.7%、1.6%或1.5%的其他大麻素,优选按组合物重量计,组合物包含少于约1.7%的其他大麻素。全部大麻素,即大麻素分馏物(cannabinoid fraction),通常占本发明组合物中存在的化合物的大部分。优选地,大麻素分馏物(不包括作为主要大麻素的THC)的含量按提取物重量计不超过约6%。
如上所述,通过本文所述方法获得的大麻植物提取物可以包含THC。按大麻植物提取物的重量计,大麻植物提取物可包含至少约60%、65%、70%、75%或80%的THC,但优选至少约70%。更优选地,通过本文所述方法获得的大麻植物提取物中THC的含量按大麻植物提取物重量计约为70%至74%(70、71、72、73、74或其任意部分,例如70.5、71.5、72.5、73.5)。优选地,大麻植物提取物中THC的含量至少约为70%。因此,本发明涉及一种可通过本文所述方法获得的大麻植物提取物,其包含按大麻植物提取物重量计含量至少约为70%的Δ9?四氢大麻酚(THC)。在THC含量方面使用的术语“约”是指比标示值多20%或少20%。在本发明的背景下,本文所述的任何特定大麻植物的THC含量可采用本领域技术人员熟知的方法进行定性和定量测定,如薄层色谱法(TLC)或高效液相色谱法(HPLC)。
对于本领域技术人员显而易见的是,在本文所述的方法中(特别是在浸渍和或渗滤步骤中),从大麻植物材料(优选为大麻花部材料)中去除的不仅是THC,还有大麻植物的其他物质。换言之,除了THC之外,大麻花部材料中的其他物质也会溶解在溶剂(优选乙醇)中。如上所述,通过所述方法获得的大麻植物提取物可能还包括萜烯和/或萜类。萜烯的非限制性实例为:α?红没药醇、愈创醇、β?石竹烯、α?蒎烯、莰烯、β?蒎烯、β?月桂烯、Δ?3?蒈烯、松油烯、对伞花烃、柠檬烯、桉油精、罗勒烯、γ?松油烯、异松油烯、芳樟醇、异蒲勒醇、香叶醇、α?蛇麻烯、橙花叔醇、氧化石竹烯、松油醇、瓦伦烯、水芹烯、葑醇、龙脑、叶绿醇、桧烯、樟脑、异龙脑、薄荷醇、柏木烯和/或角鲨烯。因此,通过本文所述的方法获得的大麻植物提取物还可能包含α?红没药醇、愈创醇、β?石竹烯、α?蒎烯、莰烯、β?蒎烯、β?月桂烯、Δ?3?蒈烯、松油烯、对伞花烃、柠檬烯、桉油精、罗勒烯、γ?松油烯、异松油烯、芳樟醇、异蒲勒醇、香叶醇、α?蛇麻烯、橙花叔醇、氧化石竹烯、松油醇、瓦伦烯、水芹烯、葑醇、龙脑、叶绿醇、桧烯、樟脑、异龙脑、薄荷醇、柏木烯和/或角鲨烯。优选通过本文所述的方法获得的大麻植物提取物包含α?红没药醇、愈创醇和/或β?石竹烯。
此外,通过本文所述方法获得的大麻植物提取物可能还包括类黄酮。类黄酮的非限制性实例为山奈酚、槲皮素、荭草苷、牡荆碱、芹菜素、金丝桃苷、芸香苷、木犀草素?7?葡萄糖苷、杨梅素、异牡荆素、异槲皮素、芹菜苷、木犀草素、大麻黄素A和大麻黄素B。
此外,通过本文所述方法获得的大麻植物提取物可能还包括植物甾醇和/或维生素。植物甾醇和/或维生素的非限制性实例为:β?谷甾醇、菜油甾醇、豆甾醇和α?生育酚(维生素E)。
通过本文所述方法获得的大麻植物提取物可以具有如图1和表1至表7所示的上述物质的浓度。
因此,还可以设想通过本文所述方法获得的大麻植物提取物包含Δ9?四氢大麻酚(THC)和萜烯和/或萜类。通过本文所述方法获得的大麻植物提取物可包括Δ9?四氢大麻酚 (THC)和选自α?红没药醇、愈创醇和β?石竹烯的萜烯。因此,本发明涉及一种可通过本文所述方法获得的大麻植物提取物,该提取物包含Δ9?四氢大麻酚(THC)和选自α?红没药醇、愈创醇和β?石竹烯的萜烯。
优选地,根据本文所述方法获得的大麻植物提取物天然含有THC和α?红没药醇、愈创醇和/或β?石竹烯。因此,通过本文所述的方法获得的大麻植物提取物优选为来源于/获自内源性含有或产生THC和α?红没药醇、愈创醇和/或β?石竹烯的植物的提取物。这种植物提取物可以来源于/获自内源性含有或产生大麻素、大麻素样物质和/或大麻素类化合物以及萜烯和/或萜类的植物,只要它们能够产生THC和α?红没药醇、愈创醇和/或β?石竹烯。或者,通过本文所述的方法获得的大麻植物提取物是来源于/获自能够产生大麻素、大麻素样物质或大麻素类化合物以及萜烯和/或萜类的植物,但该植物本身并不内源性地含有或产生这些物质。因此,通过本文所述的方法获得的大麻植物提取物也可以来源于能够在生物合成过程中异源性产生THC和α?红没药醇、愈创醇和/或β?石竹烯的转基因植物。
如上所述,本发明还涉及一种药物制剂,其包含植物提取物,优选为通过本文所述方法获得的大麻植物提取物。药物制剂可以具有通过本文所述方法获得的大麻植物提取物的化学成分,或者可以含有通过本文所述方法获得的大麻植物提取物和其他物质,包括但不限于任意合适浓度的载体、表面活性剂、增稠剂、佐剂等。如本文所述,在将大麻植物提取物加入药物制剂之前,例如在减压(如真空)下加热提取物可以完全或部分去除本文所述的溶剂。本领域技术人员知晓,一些挥发性植物代谢物可以用溶剂去除。或者,溶剂也可以作为载体加入药物制剂中。
本文所用的术语“药物制剂”一般是指适合应用/施用于人体以治疗、护理或改善人体外观的制剂。本发明的药物制剂特别适用于患者,优选为人类患者。然而,也可以设想用本发明所述的大麻植物提取物治疗动物,特别是伴侣动物。术语“药物制剂(pharmaceutical formulation)”可与“药品(medicament)”互换使用。
设想本文所述的组合物或药物制剂可用于医药。
同样,可以设想通过本文所述方法获得的植物提取物、优选为大麻植物提取物(浸膏)可用于医药。因此,本发明涉及一种可通过本文所述方法获得的用于医药的大麻植物提取物(浸膏)。
换言之,本发明涉及一种治疗方法,包括向有需要的受试者施用可通过本文所述方法获得的大麻植物提取物(浸膏)。
本文所述的药物制剂可用于治疗和/或预防与疼痛相关的病症和/或疾病。
具体地,本发明涉及一种可通过本文所述方法获得的大麻植物提取物(浸膏),用于治疗和/或预防癌症疼痛、急性非癌症疼痛、慢性非癌症疼痛和/或复杂疼痛综合征,更具体地说是慢性癌症疼痛、躯体疼痛、内脏疼痛、中枢神经疼痛、周围神经疼痛和/或复杂疼痛综合征。癌症疼痛的具体实例是慢性癌症疼痛。急性非癌症疼痛的具体实例是躯体疼痛,包含拔牙、小型皮肤手术、骨骼创伤、整形外科手术或紧张性头痛引起/导致的疼痛,以及内脏疼痛,包括痛经、急性胰腺炎或肾/胆绞痛引起/导致的疼痛。慢性非癌症疼痛的具体实例是神经病理性疼痛,如中枢神经病理性疼痛,包含中风后丘脑疼痛或脊髓损伤引起/导致的疼痛,以及周围神经病理性疼痛,包含带状疱疹后遗神经痛、糖尿病痛性神经病变、三叉神经痛、特发性小纤维多发性神经病变或抗逆转录病毒疗法引起/导致的神经病。复杂疼痛综合征的具体实例包含纤维肌痛综合征、复杂区域疼痛综合征和偏头痛。
换言之,本发明涉及一种治疗癌症疼痛、急性非癌症疼痛、慢性非癌症疼痛和/或复杂疼痛综合征的方法,更具体地是慢性癌症疼痛、躯体疼痛、内脏疼痛、中枢神经病理性疼痛、周围神经病理性疼痛和/或复杂疼痛综合征的方法,包含向有需要的受试者施用可通过本文所述方法获得的大麻植物提取物。
本文使用的术语“治疗”及其各种词性应理解为影响受试者、组织或细胞以获得所需的药理学和/或生理学效果,即部分或完全治愈疾病或相关症状。术语“预防”及其各种词性应理解为对受试者进行预防性治疗,即完全或部分防止疾病或相关症状的发生、阻止其发展或减轻其严重程度。本文所用术语“受试者”是指哺乳动物,优选为人类。
此类方法和用途包含向有需要的患者施用有效量的本文所述大麻植物提取物、制剂或药物制剂。术语“有效量”应理解为当施用于患者时,其用量足以达到预期效果。“治疗有效量”可由主治医生确定。
本文公开的大麻植物提取物、组合物或药物制剂可局部或全身施用。可通过任何合适的方式施用,包括口服、口腔黏膜施用、直肠施用、鼻腔施用、局部施用(包括皮肤施用、口腔施用和舌下施用)、阴道施用或肠外施用(包括肌肉注射、皮下注射和静脉注射),或以适合吸入或充气给药的形式施用。本文公开的药物制剂优选通过口服、口腔粘膜或局部施用以及吸入施用。最优选的是通过口服施用。
通过本文所述方法获得的大麻植物提取物可以通过本领域已知的任何方法进一步加工,以获得适合动物或人类服用的组合物和/或药物制剂。换言之,药物制剂可以通过本领域已知的任何方法制备。换言之,药物制剂可以通过本领域已知的任何方法,从通过本文所述方法获得的大麻植物提取物中制备。药物制剂可以制备成固体,如片剂或灌装胶囊,也可以制备成液体,如溶液、悬浮液、乳剂、酏剂或灌装胶囊,所有这些都可用于口服,也可制成栓剂用于直肠施用,或制成无菌注射液用于非肠道施用(包括皮下注射)。用于非肠道施用的制剂包括无菌水溶液或非水溶液、悬浮液和乳剂。
本领域技术人员将理解,本文所述的药物制剂的配制是为了适用于患者、与组合物中的药物活性物质相容并且不会引起任何不合理的安全性或毒性问题。本文所述的药物制剂可以合适的剂量施用于受试者。剂量方案将由主治医生和临床因素决定。
附图和示例也对本发明进行了说明。
附图说明
图1:对通过本文所述方法获得的大麻植物浸膏进行分析,方法如实施例部分第6节所述。D9?THC=Δ9?THC
图1
具体实施方式
以下实施例用于说明本发明
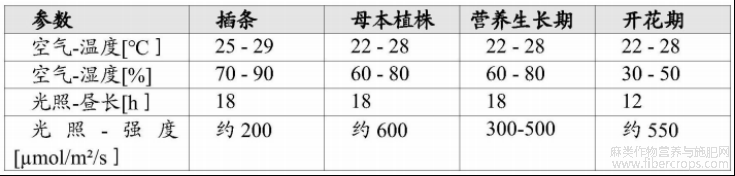
1.大麻植物材料的栽培
栽培在封闭的温室中进行,温室通过HVAC系统提供过滤空气。为避免疾病传播,栽培过程中使用益昆虫,并由经过培训的园艺师定期目视检测植物有无病害。大麻植物可以通过从母本植株上获取插条进行繁殖。因此,母本植株被用作生产植物的种群(stock)。从母本植株上获取的插条插在岩棉块中,在温度约为25℃至29℃、空气湿度较高(通常为70%至90%的相对湿度)的环境中强制生根3周。生根后,植物进入营养生长阶段,在温度约为22 ℃至28℃、相对湿度约为60%至80%的环境中生长约2周,植物逐渐变大。当植物足够大并准备好开花,通过将光照时间从每天18h减少到每天12h启动开花期。花期结束时(8至9周后),从茎上采摘雌花。从茎的下部切下,将花部与茎分开。将分离的花部修剪后,在26℃的干燥箱中干燥96h,并不断去除潮湿空气。
2.提取干燥花部
花部在干燥步骤前进行修剪,且其Δ9?THC当量(Δ9?THC+Δ9?THCA*0.877)的最低含量按重量计为10%。每千克干燥花部使用了16.7kg(15.9kg?17.5kg)的96%(v/v)的药用级乙醇(Kraul&Wilkening u.Stelling GmbH)。提取过程在圆柱形、底部配有滤网的药用级不锈钢提取容器(由Edelstahlbau Tannroda GmbH公司定制)中、在15℃至25℃的温度和避光条件下进行。提取过程分为浸渍(静态提取)和渗滤(流动提取)。在浸渍过程中,首先用一半量的乙醇(每千克花8.35kg±5%)浸泡干燥花部材料24h±1h,这样可以溶解大部分Δ9?THC和其他大麻素以及相关的次生植物物质,如萜烯(芳香物质)、脂肪和叶绿素。浸渍后,向油水混合物中加入另一半量的乙醇,并开始渗滤。这样,乙醇和大麻提取物的油水混合物以每千克新鲜花部材料4.0至5.0ml/min的流速渗入新鲜花部材料中,持续69至86h,并收集到由药用不锈钢制成的移动缓冲罐中。
3.渗滤物过滤
通过药用级、沉积率为1.5μm的聚丙烯颗粒过滤器(Pall GmbH,货号:AB2A0157PH4)对渗滤物进行过滤,去除未通过提取容器的滤网分离的较小花部残留物。将过滤器插入不锈钢外壳,用蠕动泵将渗滤物泵入过滤器,然后收集到不锈钢罐中。工作压力和温度分别不得超过5bar和50℃。
4.渗滤物浓缩
使用旋转蒸发仪(制造商:Büchi;型号:Rotavapor R?220Pro;蒸馏速率:高达12L 乙醇/h;烧瓶尺寸:20L;烧瓶最大容量:12L;连续进样)在真空中蒸发提取溶剂。水浴温度、压力和转速分别为72℃、185mbar和150r/min。这些条件导致乙醇的蒸发汽温度为41℃?42 ℃,蒸发性能约为10L/h。当蒸汽温度降到30℃以下时,蒸发过程结束,表明乙醇几乎被完全去除。获得一种几乎无溶剂的浸膏,呈深绿色至深棕色树脂状,主要由Δ9?THCA和部分活化的Δ9?THC组成。
5.无溶剂浸膏的脱羧处理
Δ9?THCA完全转化为Δ9?THC的过程是通过真空热诱导脱羧进行的。因此,使用旋转蒸发仪将水浴温度、压力和转速分别调至80℃、185mbar和150r/min。脱羧时间为72h。所得浸膏仍为深绿色至深棕色树脂状,Δ9?THC的平均含量按提取物重量计为70%至74%。干燥花部和浸膏之间的转换系数平均为4.7。
6.提取物分析
通过目视检查来确定大麻植物浸膏颜色为黄色至绿色。
根据《欧洲药典2 .2 .27》(Ph .Eur .2 .2 .27)并根据DAB专著“Eingestellter Cannabisextrakt”进一步分析该提取物。根据《欧洲药典2.2.29》(Ph.Eur.2.2.29)并基于 DAB专著“Eingestellter Cannabisextrakt”的内部验证方法,通过比较大麻素谱与参考标准的保留时间以及本产品的参考色谱图,使用高效液相色谱(HPLC)分析进一步分析该提取物。
根据《欧洲药典2.2.28》(Ph.Eur.2.2.28)和经内部验证的GC?MS方法,通过比较萜烯/萜类谱与参考标准的保留时间和本产品的参考色谱图进一步分析该提取物。含水量根据《欧洲药典2.5.12》(Ph.Eur.2.5.12)(Karl Fischer)来测定,且乙醇含量根据《欧洲药典》(Ph.Eur.2.2.28)和经内部验证的GC方法进行分析。微生物杂质可根据《欧洲药典5.1.4?2》(Ph.Eur.5.1.4?2)包括《欧洲药典2.6.12和2.6.31》(Ph.Eur.2.6.12and 2.6.31)进行分析。
提取物的分析结果如图1和表1至表7所示。
7.所得提取物中蜡的分析
将1.00kg浸膏与1.75kg乙醇混合并搅拌30分钟。所得到的溶液用71μm的金属筛网过滤,然后加入乙醇,得到浸膏与乙醇的比例为1:2.3的浸膏?乙醇溶液。将溶液放入冰箱冷冻48h(冬化)。48h后,顶部没有明显的脂肪层,只看到一些小的不透明斑块/条纹。使用50μm和第二个21μm金属筛网进行过滤。收集到深色脂肪物质。将收集到的深色脂肪溶于约30ml乙醇并离心。得到约20g的蜡,这意味着蜡的含量约为2%。
文章摘自国家发明专利,一种植物提取物的生产方法,发明人:维尔塔尼科有限公司,申请号:202380019002.2,申请日:2023.01.27