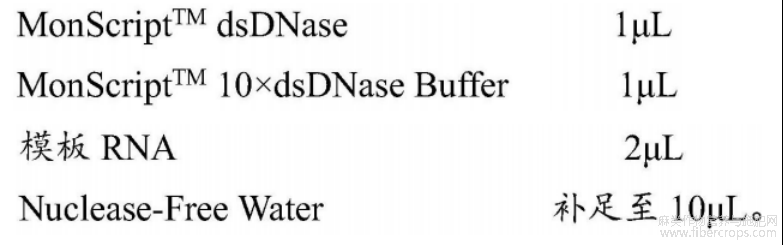摘 要:本发明属于分子生物学技术领域,涉及工业大麻种子萌发响应干旱胁迫表达的CsbHLH100基因及其扩增引物和检测方法。本发明提供了工业大麻种子萌发响应干旱胁迫表达的CsbHLH100基因,所述CsbHLH100基因的核苷酸序列如SEQIDNO.1所示。本发明为工业大麻抗旱育种提供了候选基因。
权利要求书
1.工业大麻种子萌发响应干旱胁迫表达的CsbHLH100基因,其特征在于,所述CsbHLH100基因的核苷酸序列如SEQIDNO.1所示。
2.扩增权利要求1所述CsbHLH100基因的引物,其特征在于,所述引物包括上游引物100Seq-F和下游引物100Seq-R,所述上游引物100Seq-F的核苷酸序列如SEQIDNO.2所示,所述下游引物100Seq-R的核苷酸序列如SEQIDNO.3所示。
3.一种检测CsbHLH100基因在工业大麻种子萌发响应干旱胁迫的差异表达的引物,其特征在于,所述引物包括上游引物100Q-F和下游引物100Q-R,所述上游引物100Q-F的核苷酸序列如SEQIDNO.4所示,所述下游引物100Q-R的核苷酸序列如SEQIDNO.5所示。
4.一种检测CsbHLH100基因在工业大麻种子萌发响应干旱胁迫的差异表达的试剂盒,其特征在于,包括权利要求3所述引物和反应液。
5.一种检测CsbHLH100基因在工业大麻种子萌发响应干旱胁迫的差异表达方法,其特征在于,包括以下步骤:
干旱胁迫处理工业大麻种子,提取总RNA,合成cDNA第一链,采用权利要求3所述引物,使用PCR方法,检测CsbHLH100基因在工业大麻种子中受干旱胁迫的差异表达情况。
6.根据权利要求5所述的方法,其特征在于,当所述PCR方法为qRT-PCR时,所述扩增的反应体系每20μL包括:2×SYBRGreenMasterMix10μL,10μM上游引物100Q-F0.4μL,10μM下游引物100Q-R0.4μL,cDNA模板2μL,10×ROXreferencedye2μL,RNasefreeddH2O5.2μL。
7.根据权利要求6所述的方法,其特征在于,所述扩增的反应程序包括:95℃预变性120s;95℃变性5s,60℃退火30s,40个循环。
8.根据权利要求5所述的方法,其特征在于,所述工业大麻种子设为对照组和干旱胁迫组,对照组添加蒸馏水,干旱胁迫组添加20%PEG-6000模拟干旱胁迫,培养7d。
9.根据权利要求6所述的方法,其特征在于,所述qRT-PCR中,内参基因为EF1a。
10.根据权利要求9所述的方法,其特征在于,扩增所述内参基因EF1a的引物包括上游引物EF1a-F和下游引物EF1a-R,所述上游引物EF1a-F的核苷酸序列如SEQIDNO.6所示,所述下游引物EF1a-R的核苷酸序列如SEQIDNO.7所示。
技术领域
本发明属于分子生物学技术领域,具体涉及工业大麻种子萌发响应干旱胁迫表达的CsbHLH100基因及其扩增引物和检测方法。
背景技术
大麻(Cannabis sativa L.)为大麻科(Cannabaceae)大麻属植物,又称火麻、汉麻、线麻。工业大麻是指其任何部位四氢大麻酚(tetrahydrocannabinol,THC)含量低于0.3%的大麻品种类型。为了不跟粮食争地,工业大麻一般种植在山坡地等非粮地,易受到干旱胁迫的影响。
种子萌发和幼苗建成是植物生命周期的关键阶段,也是对外界环境因子反应最敏感的时期。在工业大麻实际生产中,经常出现因干旱造成播种后出苗少或出苗不一致,甚至不出苗的问题,几乎每年都有发生,只能进行重播、补种或者补苗,最终造成人力、物力和财力的损失,严重制约了工业大麻的发展。因此,大麻的抗旱育种是实现工业大麻高产优质发展所迫切需要解决的问题,挖掘工业大麻的抗旱相关基因是其育种的基础和前提。
发明内容
本发明的目的在于提供工业大麻种子萌发响应干旱胁迫表达的CsbHLH100基因及其扩增引物和检测方法。本发明提供了工业大麻种子萌发响应干旱胁迫表达的CsbHLH100基因,本发明为工业大麻抗旱育种提供了候选基因。
本发明提供了工业大麻种子萌发响应干旱胁迫表达的CsbHLH100基因,所述CsbHLH100基因的核苷酸序列如SEQIDNO.1所示。
本发明还提供了扩增上述技术方案所述CsbHLH100基因的引物,所述引物包括上游引物100Seq-F和下游引物100Seq-R,所述上游引物100Seq-F的核苷酸序列如SEQIDNO.2所示,所述下游引物100Seq-R的核苷酸序列如SEQIDNO.3所示。
本发明还提供了一种检测CsbHLH100基因在工业大麻种子萌发响应干旱胁迫的差异表达的引物,所述引物包括上游引物100Q-F和下游引物100Q-R,所述上游引物100Q-F的核苷酸序列如SEQIDNO.4所示,所述下游引物100Q-R的核苷酸序列如SEQIDNO.5所示。
本发明还提供了一种检测CsbHLH100基因在工业大麻种子萌发响应干旱胁迫的差异表达的试剂盒,包括上述技术方案所述引物和反应液。
本发明还提供了一种检测CsbHLH100基因在工业大麻种子萌发响应干旱胁迫的差异表达方法,包括以下步骤:
干旱胁迫处理工业大麻种子,提取总RNA,合成cDNA第一链,采用上述技术方案所述引物,使用PCR方法,检测CsbHLH100基因在工业大麻种子中受干旱胁迫的差异表达情况。
优选的是,当所述PCR方法为qRT-PCR时,所述扩增的反应体系每20μL包括:2×SYBRGreenMasterMix10μL,10μM上游引物100Q-F0.4μL,10μM下游引物100Q-R0.4μL,cDNA模板2μL,10×ROXreferencedye2μL,RNasefreeddH2O5.2μL。
优选的是,所述扩增的反应程序包括:95℃预变性120s;95℃变性5s,60℃退火30s,40个循环。
优选的是,所述工业大麻种子设为对照组和干旱胁迫组,对照组添加蒸馏水,干旱胁迫组添加20%PEG-6000模拟干旱胁迫,培养7d。
优选的是,所述qRT-PCR中,内参基因为EF1a。
优选的是,扩增所述内参基因EF1a的引物包括上游引物EF1a-F和下游引物EF1a-R,所述上游引物EF1a-F的核苷酸序列如SEQIDNO.6所示,所述下游引物EF1a-R的核苷酸序列如SEQIDNO.7所示。
本发明提供了工业大麻种子萌发响应干旱胁迫表达的CsbHLH100基因。本发明首次提出了工业大麻种子萌发响应干旱胁迫表达的CsbHLH100基因,本发明为工业大麻抗旱育种提供了候选基因。试验结果表明,基因CsbHLH100在经过干旱胁迫处理后在“云麻1号”和“云麻7号”中的相对表达量相较对照下降2.5倍和14倍,说明该基因在工业大麻种子萌发受到干旱胁迫后表达量下降。基因CsbHLH100在经过干旱胁迫处理后在“云麻7号”中的相对表达量相较“云麻1号”下降的倍数更多,而“云麻7号”种子的萌发抗旱性比“云麻1号”强(如图3、4所示),说明基因CsbHLH100在工业大麻种子萌发受到干旱胁迫后能迅速的参与干旱胁迫响应过程,该基因通过表达量的下调从而调控工业大麻的萌发抗旱性。本发明为认识工业大麻bHLH转录基因CsbHLH100的抗逆机制,以及工业大麻进行分子育种提供了技术支撑。
本发明还提供了扩增和检测CsbHLH100基因的引物和方法,进一步提供了一种检测CsbHLH100基因在工业大麻种子萌发响应干旱胁迫的差异表达的方法。本发明为提高现有工业大麻的萌发抗旱性,使工业大麻在干旱逆境中能高产稳产从而适应近年来气候恶化的情况奠定了基础。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
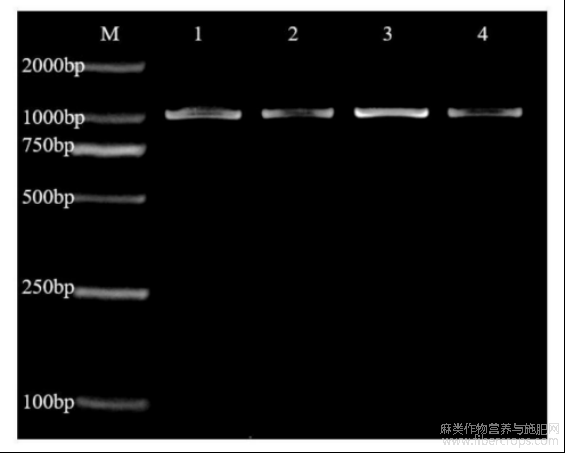
图1为本发明提供的基因CsbHLH100的RT-PCR扩增结果;其中,M:DNAmakerDL2000;泳道1(Y1-CK)、泳道2(Y1-PEG)、泳道3(Y7-CK)、泳道4(Y7-PEG)分别为CsbHLH100的扩增产物;Y1表示“云麻1号”(纤维用工业大麻品种,抗旱性弱),Y7表示“云麻7号”(花叶用工业大麻品种,抗旱性强),CK表示对照组,PEG-6000表示干旱胁迫组;
图1
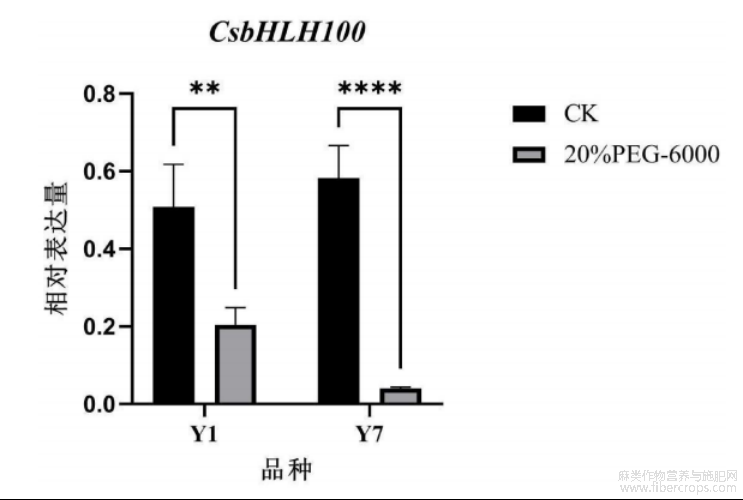
图2为本发明提供的qRT-PCR技术检测基因CsbHLH100在不同抗旱性工业大麻品种种子萌发响应干旱胁迫的差异表达图;其中,纵坐标表示基因CsbHLH100的相对表达量,横坐标表示不同工业大麻品种的名称;CK表示对照组,PEG-6000表示干旱胁迫组;**表示差异显著水平达到P<0.01,****表示差异显著水平达到P<0.0001;
图2
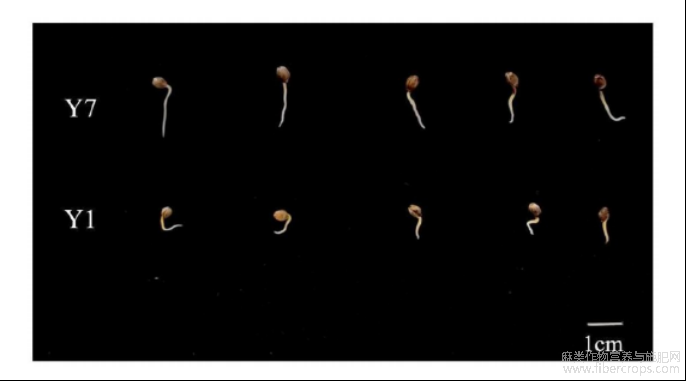
图3为本发明提供的不同抗旱性工业大麻品种种子萌发差异图;其中,Y1表示“云麻1号”,Y7表示“云麻7号”;两个品种均为干旱胁迫下的萌发状态;
图3
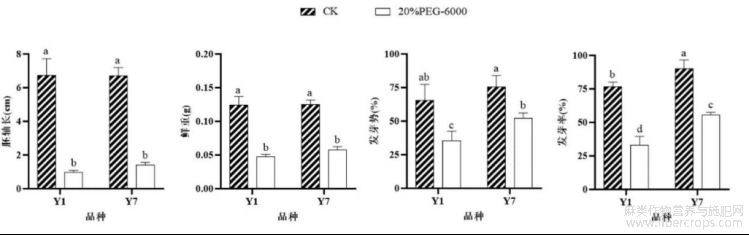
图4为本发明提供的不同抗旱性工业大麻品种萌发种子形态指标差异图;其中纵坐标表示各形态指标,横坐标表示不同工业大麻品种的名称;Y1表示“云麻1号”,Y7表示“云麻7号”,CK表示对照组,20%PEG-6000表示干旱胁迫组;不同小写字母表示差异显著水平达到P<0.05;
图4
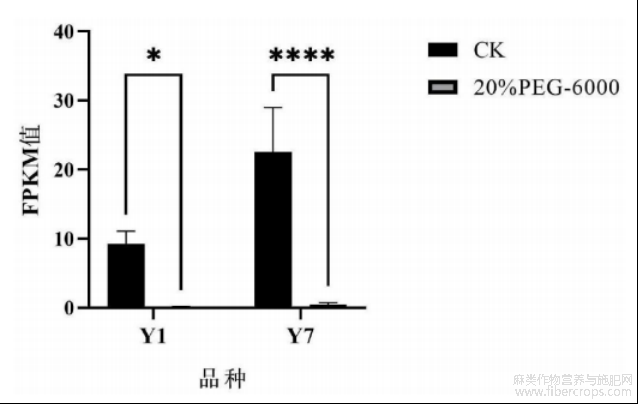
图5为本发明提供的转录组测序技术(RNAsequencing)检测基因CsbHLH100在不同抗旱性工业大麻品种种子萌发响应干旱胁迫的差异表达图;其中,纵坐标表示基因CsbHLH100的转录组测序的FPKM值,横坐标表示不同工业大麻品种的名称;CK表示对照组,PEG-6000表示干旱胁迫组;*表示差异显著水平达到P<0.05,****表示差异显著水平达到P<0.0001。
图5
具体实施方式
本发明提供了工业大麻种子萌发响应干旱胁迫表达的CsbHLH100基因,所述CsbHLH100基因的核苷酸序列如SEQIDNO.1所示:aacaaaataaaacccccaaaattatatttttatagaattaagtgtagagatgattaggtagctagtgacgatttctatcatgttcatacatatatatatacatacatatgtatgcatcgatcacttatttcattgaaagtattagtcaataagtgatatcaaattaagtaacccaaccaggcagatcgaccatattacaatttataacaatacaatgttggctttttctcctcctcctcctcctttgttttctaccaataagcccaataacattgtgggatggcctttcgatgatctaacacgctttgaagaccaaaactacttgttttcagactatgatcaataccccctcttatttctcaatacttataacctccacactttaccaccaccgtccgatcaacataataatcacaatcatcaacggttcgaagttgatcgctccgctacgccatcctcatccacggccaccgccattaacagtgatctgactatggtggagaagaagcttaatcataatgctagtgagcgtgatcgaagaaagaaagtcaaccatatgtattctgctcttcgttccctacttccaccttcagatcatacgaaaaaattgagcattccggcaacagtgtctcgtgtgctaaaatacgtaccagagctacaggaagaagtggagagtctagttcttaaaaaggaagagctattgtcaaaaataaattcaatgcagcaagggaaaacaattactgctactactactgctaatcaagagattaagaaagtaaaaaacataggtccaaactcattatcctctatttctgcaactcaactcagtgagaaagaaattgctgttcaaatattgtcttataaagccgacaacgacctcttgtctgaaatgttgcataattatgaaattgaaggcctttcattactccatgcctcttcatttgagtccattggaggaaggctcttccataatttacatcttcaggctgaggtatcatattgtatggaaagtgggactaccatagatgccaatcttttatctcttcacgacaataaggagaagttattggttgtgcaataactcttctagactttggatgtgtatgtaaactgaaggggatctctgtatcatatgtagtcttttagtttgttaagttttgttaattagaagctgttaaaaattaaagtggttgttttagttatctaactatatatataccggtgtattgatcttctcctatataaataacaggagtgttaatcactctattttacact。本发明以两个不同抗旱性的工业大麻品种为对象,其中“云麻1号”抗旱性弱,“云麻7号”抗旱性强。试验结果表明,qRT-PCR检测基因CsbHLH100在没有干旱胁迫的情况下在工业大麻萌发种子中相对表达量为0.508(云麻1号)和0.582(云麻7号),在经过干旱胁迫处理后的工业大麻萌发种子中的相对表达量则明显下降,分别下降2.5倍和14倍;说明CsbHLH100属于受干旱胁迫诱导表达的基因,CsbHLH100在工业大麻种子萌发受到干旱胁迫后能迅速的参与干旱胁迫响应过程。CsbHLH100基因在工业大麻种子萌发阶段,响应干旱胁迫进行差异表达,本发明为大麻抗旱育种提供了候选基因。
本发明还提供了扩增上述技术方案所述CsbHLH100基因的引物,所述引物包括上游引物100Seq-F和下游引物100Seq-R,所述上游引物100Seq-F的核苷酸序列如SEQIDNO.2所示:5'-aaccaggcagatcgaccata-3',所述下游引物100Seq-R的核苷酸序列如SEQIDNO.3所示:5'?tgatacagagatccccttcagttt?3'。本发明优选利用反转录PCR(RT?PCR)技术进行基因扩增。在本发明中,所述RT?PCR的反应体系每20μL优选包括:2×EsTaqMasterMix(Dye)10μL;10μM上游引物100Seq?F1μL;10μM下游引物100Seq?R1μL;cDNA1μL;ddH2O7μL。在本发明中,所述RT?PCR的反应程序优选包括:94℃预变性2min;94℃变性30s,58℃退火30s,72℃延伸30s,35个循环;72℃,2min。本发明扩增结束后,扩增产物优选4℃保存。本发明所述RT?PCR扩增前,优选进行总RNA的提取和cDNA第一链的合成的步骤。
本发明还提供了一种检测CsbHLH100基因在工业大麻种子萌发响应干旱胁迫的差异表达的引物,所述引物包括上游引物100Q?F和下游引物100Q?R,所述上游引物100Q?F的核苷酸序列如SEQIDNO.4所示:5'?aacacgctttgaagacca?3',所述下游引物100Q?R的核苷酸序列如SEQIDNO.5所示:5'?tcgaaccgttgatgattg?3'。本发明设计的特异引物在qRT?PCR中特异性强,无杂带产生,熔解曲线显示无引物二聚体产生。
本发明还提供了一种检测CsbHLH100基因在工业大麻种子萌发响应干旱胁迫的差异表达的试剂盒,包括上述技术方案所述引物和反应液。在本发明中,所述反应液优选包括2×SYBRGreenMasterMix和10×ROXreferencedye。
本发明还提供了一种检测CsbHLH100基因在工业大麻种子萌发响应干旱胁迫的差异表达方法,包括以下步骤:
干旱胁迫处理工业大麻种子,提取总RNA,合成cDNA第一链,采用上述技术方案所述引物,使用PCR方法,检测CsbHLH100基因在工业大麻种子中受干旱胁迫的差异表达情况。
在本发明中,当所述PCR方法为qRT?PCR时,所述扩增的反应体系优选每20μL包括:2×SYBRGreenMasterMix10μL,10μM上游引物100Q?F0.4μL,10μM下游引物100Q?R0.4μL,cDNA模板2μL,10×ROXreferencedye2μL,RNasefreeddH2O5.2μL。在本发明中,所述扩增的反应程序优选包括:95℃预变性120s;95℃变性5s,60℃退火30s,40个循环。扩增结束后,扩增产物优选4℃保存。qRT?PCR采用SYBRGreenI嵌合荧光法进行,具有特异性强,灵敏度高,重复性好等特点。在本发明中,所述工业大麻种子优选设为对照组和干旱胁迫组,对照组添加蒸馏水,干旱胁迫组添加20%PEG?6000模拟干旱胁迫,培养7d。
在本发明中,所述qRT?PCR中,内参基因优选为EF1a。本发明选择较合适工业大麻种子萌发的内参基因EF1a,其稳定性更高。在本发明中,扩增所述内参基因EF1a的引物包括上游引物EF1a?F和下游引物EF1a?R,所述上游引物EF1a?F的核苷酸序列如SEQIDNO.6所示:5'?cagttgagatgcaccacgag?3',所述下游引物EF1a?R的核苷酸序列如SEQIDNO.7所示:5'?ttgccaatttgaccagggtg?3'。
本发明检测方法能够实现工业大麻种子萌发阶段,基因CsbHLH100响应干旱胁迫的差异表达情况。
为了进一步说明本发明,下面结合附图和实施例对本发明提供的工业大麻种子萌发响应干旱胁迫表达的CsbHLH100基因及其扩增引物和检测方法进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
实验材料:纤维用工业大麻品种“云麻1号”和花叶用工业大麻品种“云麻7号”。抗旱性验证结果如图3和图4所示。根据图3可知,“云麻7号”在干旱胁迫下的萌发状态比“云麻1号”好。根据图4可知,“云麻1号”干旱胁迫组的胚轴长相较对照组下降了85.76%,而“云麻7号”下降了78.90%;“云麻1号”干旱胁迫组的鲜重相较对照组下降了61.39%,“云麻7号”下降了53.51%;在发芽势上,“云麻1号”和“云麻7号”分别下降了45.76%和30.88%;在发芽率上,“云麻1号”和“云麻7号”分别下降了57.25%和38.27%。以上结果均表明,“云麻1号”抗旱性弱,“云麻7号”抗旱性强。
实施例1
工业大麻种子萌发响应干旱胁迫表达的基因CsbHLH100的获得:
一、设计扩增工业大麻CsbHLH100基因全长序列的专用引物
根据前期工业大麻干旱胁迫下的转录组测序发现,bHLH100的同源基因CsbHLH100为差异表达基因,且在“云麻1号”和“云麻7号”的表达量均显著下降(图5),暗示CsbHLH100基因与工业大麻的萌发抗旱密切相关。据于此,利用生物软件Primer5.0设计扩增基因CsbHLH100的专用引物。CsbHLH100专用引物由上游引物100Seq?F和下游引物100Seq?R组成(上游引物100Seq?F的核苷酸序列如SEQIDNO.2所示:5'?aaccaggcagatcgaccata?3',下游引物100Seq?R的核苷酸序列如SEQIDNO.3所示:5'?tgatacagagatccccttcagttt?3'),引物由北京擎科生物科技股份有限公司昆明分公司合成。
二、工业大麻种子萌发幼苗的总RNA提取(用美基生物公司提供的HiPurePlantRNAMiniKit进行总RNA的提取)
(1)干旱胁迫处理:挑选大小、外形一致“云麻1号”和“云麻7号”的种子,使用70%酒精消毒,蒸馏水冲洗干净并晾干备用。随机挑选30粒种子,均匀摆放于9cm培养皿内,正常萌发处理(对照组)加入蒸馏水9ml,干旱胁迫处理(干旱胁迫组)加入20%聚乙二醇6000(PEG?6000)溶液9ml。置于培养箱中培养,培养条件:暗培养3d后;于光照12h,温度25℃,黑暗12h,温度20℃条件下继续培养4d。在培养7d时取萌发种子或幼苗,每组不同处理设置3个生物学重复。取样后放至液氮中速冻,于?80℃超低温冰箱保存备用。
(2)将对照组的“云麻1号”和“云麻7号”、干旱胁迫组的“云麻1号”和“云麻7号”的种子或幼苗分别置于研钵中加液氮研磨成细小粉末,每200mg样品加入800μLBufferRLC,高速涡旋15~30s打散样品,室温静置3min;在室温下,12000rpm离心5min。
(3)把gDNAFilterColumn装在2ml收集管中,转移上清液转移至过滤柱中,12000rpm离心2min,弃去gDNA过滤柱。
(4)向得到的滤液中加入0.5倍体积的无水乙醇,用移液枪吸打3~5次混匀。
(5)把HiPureRNAMiniColumn装在2ml收集管中,转移≤700μL混合液至柱子中。12000rpm离心30~60s(若混合液超过700μL,则倒弃滤液,把柱子装回收集管中,转移剩余混合液至柱子中12000rpm离心30~60s)。
(6)倒弃滤液,把柱子装回收集管中,加入500μLBufferRW1至柱子中。10000rpm离心30~60s。
(7)倒弃滤液,把柱子装回收集管,加入500μLBufferRW2至柱子中,12000rpm离心30~60s,该步骤重复两次。
(8)倒弃滤液,把柱子装回收集管,12000rpm离心2min。将柱子转移至1.5ml离心管,加入30~100μLRNaseFreeWater至柱子膜中央。
(9)室温静置2min,12000rpm离心1min,弃去柱子,滤液即RNA,存于?80℃超低温冰箱中。
三、cDNA第一链的合成(用莫纳生物公司提供的MonScriptTMRTIIISuperMixwithdsDNase(Two-Step)进行cDNA第一链的合成)
(1)将模板RNA、MonScriptTMdsDNase、MonScriptTM10×dsDNaseBuffer、Nuclease-FreeWater、MonScriptTM5×RTIIISuperMix在冰上解冻,整个反应体系于冰上配置。使用前将每种溶液涡旋振荡混匀,简短离心(6000rpm,30s)以收集残留在管壁的液体。为了保证反应液配制的准确性,进行各项反应时,先配制成混样,然后再分装到每个反应管中。
(2)按照以下体系进行RNA中的gDNA去除体系配制混合液,轻柔吸打混匀。简短离心(6000rpm,30s),并置于37℃温育2min,以去除基因组DNA污染;然后于55℃温育5min,使dsDNase失活。置于冰上。
gDNA去除反应体系:
(3)按照以下体系的进行第一链cDNA合成,轻柔吸打混匀。简短离心(6000rpm,30s),50℃温育15min,反应结束后85℃温育5min以终止反应,将获得的cDNA溶液于冰上放置用于后续实验,或低温-20℃保存。
反转录反应体系:
MonScriptTM5×RTIIISuperMix4μL
步骤(2)反应得到的产物10μL
Nuclease-FreeWater补足至20μL
四、工业大麻CsbHLH100基因的扩增
以步骤三(3)反转录获得的cDNA作为RT-PCR反应的模板,以步骤一中设计的专用引物作为RT-PCR反应引物,扩增工业大麻CsbHLH100基因全长(见图1),RT-PCR反应体系:2×EsTaqMasterMix(Dye)10μL;10μM上游引物1μL;10μM下游引物1μL;cDNA1μL;ddH2O补足至20μL,总体积为20μL。PCR反应程序:94℃预变性2min;94℃变性30s,58℃退火30s,72℃延伸30s,35个循环;72℃,2min,后4℃保存。
五、目的基因的回收(用全式金生物公司提供的DNA凝胶快速纯化试剂盒回收目的基因)
PCR产物经1%琼脂糖凝胶电泳,将凝胶中的目的条带进行胶回收,胶回收使用全式金生物公司的胶回收试剂盒进行,包括步骤如下:
(1)在紫外灯下将目的条带胶块切下,尽量将不含DNA片段的空白凝胶去掉后放入1.5ml离心管中。
(2)如凝胶重100mg,可视为100μL。加入三倍体积溶于GelSolubilizationBuffer(yellow),于55℃水浴融胶6~10min,当胶完全融化后,观察溶液的颜色,如颜色为紫色,加入适量3M醋酸钠(pH5.2),调整颜色和GSB颜色相同(黄色)。为增加DNA回收量,加入1倍体积异丙醇于已融化的凝胶溶液中。
(3)高温时离心柱结合DNA能力弱,待融化的凝胶溶液降至室温后,加入离心柱中静置1min,10000rpm离心1min,弃流出液。
(4)向离心柱中加入650μL漂洗液WB,18~22℃,10000rpm离心1min,倒掉废液。
(5)重复步骤(4),倒掉废液后的离心管10000rpm离心2min,彻底去除残留的WB,保留离心柱。
(6)将吸附柱移至干净的1.5ml的离心管中,18~22℃放置2min使其残存于漂洗液中乙醇的挥发干。
(7)将离心柱置于一干净的离心管中,开盖静置1min,使残留乙醇挥发干净,在柱的中央加入30~50μLEB或去离子水(pH>7.0),室温静置1min。
(8)10000rpm离心1min,洗脱DNA,将洗脱出的DNA于?20℃保存。离心管内收集的从吸附柱膜上洗脱的溶液即是目的片段的纯化产物回收液。
扩增结果如图1所示,其中,M:DNAmakerDL2000;泳道1(Y1?CK)、泳道2(Y1?PEG)、泳道3(Y7?CK)、泳道4(Y7?PEG)分别为CsbHLH100的扩增产物;Y1表示“云麻1号”(纤维用工业大麻品种,抗旱性弱),Y7表示“云麻7号”(花叶用工业大麻品种,抗旱性强);CK表示对照组,PEG?6000表示干旱胁迫组;对扩增片段进行切胶回收后,经测序该回收片段序列与转录组获得的Unigene序列一致,即该回收产物为工业大麻CsbHLH100基因,基因全长如序列表中SEQIDNO.1所示。
实施例2
本发明所提供的一种检测基因CsbHLH100在工业大麻中受干旱胁迫的差异表达方法,包括以下步骤:
一、干旱胁迫处理
挑选大小、外形一致“云麻1号”和“云麻7号”种子,使用70%酒精消毒,蒸馏水冲洗干净并晾干备用。随机挑选30粒种子,均匀摆放于9cm培养皿内,正常萌发处理(对照组)加入蒸馏水9ml,干旱胁迫处理(干旱胁迫组)加入20%聚乙二醇6000(PEG?6000)溶液9ml。置于培养箱中培养,培养条件:暗培养3d后;于光照12h,温度25℃,黑暗12h,温度20℃条件下继续培养4d。在培养7d时取萌发种子或幼苗,每组不同处理设置3个生物学重复。取样后放至液氮中速冻,于?80℃超低温冰箱保存备用。
二、总RNA的提取(用美基生物公司提供的HiPurePlantRNAMiniKit进行总RNA的提取)
(1)将对照组的“云麻1号”和“云麻7号”、干旱胁迫组的“云麻1号”和“云麻7号”的种子或幼苗分别置于研钵中加液氮研磨成细小粉末,每200mg样品加入800μLBufferRLC,高速涡旋15~30s打散样品,室温静置3min;在室温下,12000rpm离心5min。
(2)把gDNAFilterColumn装在2ml收集管中,转移上清液转移至过滤柱中,12000rpm离心2min,弃去gDNA过滤柱。
(3)向得到的滤液中加入0.5倍体积的无水乙醇,用移液枪吸打3~5次混匀。
(4)把HiPureRNAMiniColumn装在2ml收集管中,转移≤700μL混合液至柱子中。12000rpm离心30~60s。若混合液超过700μL,则倒弃滤液,把柱子装回收集管中,转移剩余混合液至柱子中12000rpm离心30~60s。
(5)倒弃滤液,把柱子装回收集管中,加入500μLBufferRW1至柱子中。10000rpm离心30~60s。
(6)倒弃滤液,把柱子装回收集管,加入500μLBufferRW2至柱子中,12000rpm离心30~60s,该步骤重复两次。
(7)倒弃滤液,把柱子装回收集管,12000rpm离心2min。将柱子转移至1.5ml离心管,加入30~100μLRNaseFreeWater至柱子膜中央。
(8)室温静置2min,12000rpm离心1min,弃去柱子,滤液即RNA,存于-80℃超低温冰箱中。
三、cDNA第一链的合成(用莫纳生物公司提供的MonScriptTMRTIIISuperMixwithdsDNase(Two-Step)进行cDNA第一链的合成)
(1)将模板RNA、MonScriptTMdsDNase、MonScriptTM10×dsDNaseBuffer、Nuclease-FreeWater、MonScriptTM5×RTIIISuperMix在冰上解冻,整个反应体系于冰上配置。使用前将每种溶液涡旋振荡混匀,简短离心(6000rpm,30s)以收集残留在管壁的液体。为了保证反应液配制的准确性,进行各项反应时,先配制成混样,然后再分装到每个反应管中。
(2)按照以下体系进行RNA中的gDNA去除体系配制混合液,轻柔吸打混匀。简短离心(6000rpm,30s),并置于37℃温育2min,以去除基因组DNA污染;然后于55℃温育5min,使dsDNase失活。置于冰上。
gDNA去除反应体系:
(3)按照以下体系的进行第一链cDNA合成,轻柔吸打混匀。简短离心(6000rpm,30s),50℃温育15min,反应结束后85℃温育5min以终止反应,将获得的cDNA溶液于冰上放置用于后续实验,或低温-20℃保存。
反转录反应体系:
MonScriptTM5×RTIIISuperMix4μL
(2)反应得到的产物10μL
Nuclease-FreeWater补足至20μL。
四、qRT-PCR技术检测基因CsbHLH100在工业大麻种子萌发响应干旱胁迫的差异表达情况,反应在ABI公司7500荧光定量PCR仪上进行,对基因的表达情况进行分析(见图2)。
(1)qRT-PCR反应体系:
基因CsbHLH100的qRT-PCR反应体系的配置:
上游引物100Q-F碱基序列如SEQIDNO.4所示:5'-aacacgctttgaagacca-3',下游引物100Q-R的碱基序列如SEQIDNO.5所示:5'-tcgaaccgttgatgattg-3'。
内参基因EF1a的qRT-PCR反应体系的配置:
上游引物EF1a-F的碱基序列如SEQIDNO.6所示:5'-cagttgagatgcaccacgag-3',下游引物EF1a-R的碱基序列如SEQIDNO.7所示:5'-ttgccaatttgaccagggtg-3'。
(2)qRT-PCR反应程序:95℃预变性120s;95℃变性5s,60℃退火30s,40个循环。反应在ABI公司7500荧光定量PCR仪上进行分析。
结果分析:qRT-PCR检测基因CsbHLH100在没有干旱胁迫的情况下在工业大麻萌发种子中相对表达量为0.508(云麻1号)和0.582(云麻7号),在经过干旱胁迫处理后的工业大麻萌发种子中的相对表达量则明显下降,分别下降2.5倍和14倍。说明基因CsbHLH100在工业大麻种子萌发受到干旱胁迫后表达量下降,基因CsbHLH100属于受干旱胁迫诱导表达的基因,表明基因CsbHLH100在工业大麻种子萌发受到干旱胁迫后能迅速的参与干旱胁迫响应过程。
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性劳动前提下获得其他实施例,这些实施例都属于本发明保护范围。
文章摘自国家发明专利,工业大麻种子萌发响应干旱胁表达的CsbHLH100基因及其扩增引物和检测方法;发明人:杜光辉,杨宇蕾,汤开磊,杨阳,欧阳文静,刘飞虎;申请号 202410636013.1;申请日 2024.05.21