摘 要:本研究以一氧化氮(NO)为供体,在盐胁迫条件下研究其对罗布麻叶片生长、苯丙氨酸解氨酶(PAL)活性、黄酮类化合物合成的影响。结果表明:在150mmol/LNaCl胁迫下,施用250μmol/LSNP可显著提高罗布麻叶片PAL活性、黄酮类化合物含量;NO清除剂血红蛋白(hemoglobin)可抑制盐胁迫下SNP对罗布麻叶片PAL活性、黄酮类化合物合成的促进作用,说明SNP是通过其分解产物NO影响这些物质的合成。推测在NaCl胁迫下,NO通过促进罗布麻黄酮类物质等次生代谢产物的合成来缓解NaCl胁迫对罗布麻的伤害。
关键词:一氧化氮;罗布麻;盐胁迫;PAL活性;黄酮类物质
近年来,一氧化氮(NO)在植物耐盐性方面的作用引起了人们的广泛关注。已有研究证明,NO在多种植物抗盐胁迫中发挥作用[1-2]。在盐胁迫条件下,用NO供体硝普钠(sodium nitroprusside,SNP)进行预处理,不仅可以促进水稻幼苗生长[3],还可以促进玉米幼苗生长和增加玉米幼苗的干重[4]。一些研究结果显示,NO参与环境胁迫诱导的次生代谢产物的产生[5-6],说明NO介导的信号通路参与逆境胁迫诱导植物次级代谢产物的生物合成。植物在逆境胁迫下诱导NO合成,继而通过促进苯丙氨酶解氨酶(PAL)活性的增加来促进次生代谢产物的合成[2,7]。
罗布麻(Apocynum venetum)为夹竹桃科多年生半灌木,具有耐盐、耐旱等特性。黄酮类化合物是植物体内广泛存在的一类次生代谢产物,也是罗布麻叶片中的主要活性化合物,已被用于治疗心脏病、高血压等疾病[8-9],在植物生长发育及抵御逆境胁迫方面发挥着重要作用。本研究以罗布麻为材料,以SNP作为NO供体,以血红蛋白(hemoglobin)作为NO清除剂,研究盐胁迫下NO对罗布麻黄酮类物质合成的影响及其抗盐机理,以期为了解罗布麻品质的形成奠定理论基础。
1材料与方法
1.1试验材料
2021年6月,在山东第一医科大学药用植物园收集多株罗布麻的主根,剪成长度为5cm的根段,植于育苗钵中培养,1个月后选取长势基本一致(高约10cm)的罗布麻幼苗移栽至塑料盆中,在温室条件下培养半个月后用于试验处理。
1.2试验方法
分别采用NaCl浓度为0(CK1)、50、100、150、200mmol/L的Hoagland营养液浇灌罗布麻,每天浇灌2次。NaCl胁迫处理16d后取样,测定罗布麻生物量和黄酮类物质含量,筛选适宜的NaCl胁迫浓度。
用合适浓度的NaCl对罗布麻进行盐胁迫处理,同时施用NO供体SNP浓度为0(CK2)、50、100、150、200、250、300μmol/L的Hoagland营养液,每隔4d施用一次。SNP处理16d后取样,用于测定罗布麻叶片的生物量,筛选合适的SNP浓度。
在筛选出合适的NaCl浓度和SNP浓度的基础上,以血红蛋白(hemoglobin)作为NO清除剂,设6个处理开展试验,研究NO对盐胁迫下罗布麻PAL活性和黄酮类物质含量的影响。6个处理分别为:对照(CK3),施用Hoagland营养液,每隔4d施用一次;SNP处理,施用SNP浓度为250μmol/L的Hoagland营养液,每隔4d施用一次;HG处理,施用血红蛋白浓度为0.1%的Hoagland营养液,每隔4d施用一次;NaCl处理,施用NaCl浓度为150mmol/L的Hoagland营养液,每隔4d施用一次;SNP+NaCl处理,施用NaCl浓度为150mmol/L、SNP浓度为250μmol/L的Hoagland营养液,每隔4d施用一次;SNP+NaCl+HG处理,施用NaCl浓度为150mmol/L、SNP浓度为250μmol/L、HG浓度为0.1%的Hoagland营养液,每隔4d施用一次。在处理4d、8d、12d和16d时取样,用于罗布麻叶片PAL活性和黄酮类物质含量的测定,每个指标重复3次。
1.3测定内容及方法
1.3.1罗布麻生长速率和叶片生物量比测定
将各处理的罗布麻叶片、根、茎于100℃下烘1h,再于80℃下烘至恒重。每个重复3株,按如下方法计算叶片生物量比:
叶片生物量比(%)=叶片生物量/总生物量×100。
1.3.2 PAL活性测定
取罗布麻叶片,按1∶2(质量体积比)的比例加入提取液(50mmol/LpH值8.0的Tris-HC1缓冲液,4mmol/LEDTA,l0mmol/L巯基乙醇,1μmol/L亮抑蛋白酶肽),冰浴研磨,4℃下10000r/min离心15min。取上清液1mL,按郝岗平等[2]的方法测定苯丙氨酸解氨酶(PAL)活性,将A290变化0.01所需酶量计为1个酶活性单位(U)。
1.3.3罗布麻叶片总黄酮含量测定
准确称取1g烘干样品,置于索氏提取器中,用甲醇浸提8h,黄酮类化合物的提取和测定方法参照郝岗平等[2]的方法。以芦丁为标样测定黄酮类物质的含量,经比色液显色之后,在510nm下比色测定吸光度值(A),按照标准曲线计算总黄酮含量。
1.4数据统计分析方法
使用Excel2019和SPSS26.0软件进行数据分析和处理。使用One-WayANOVA比较不同处理间各项指标的差异。
2结果与分析
2.1盐胁迫对罗布麻叶片生物量比和黄酮类物质含量的影响
盐胁迫对罗布麻生长状态的影响采用叶片生物量比的指标来表示。试验结果显示,不同盐胁迫处理之间罗布麻叶片生物量比存在差异,且随着盐浓度的增加,叶片生物量比逐渐降低。由图1可以看出,当盐浓度增加到100mmol/L时,叶片生物量比与CK1差异显著(P<0.05)。
图1 盐胁迫对罗布麻叶片生物量比的影响
注:图柱上不同小写字母表示差异显著(P<0.05)。下同。
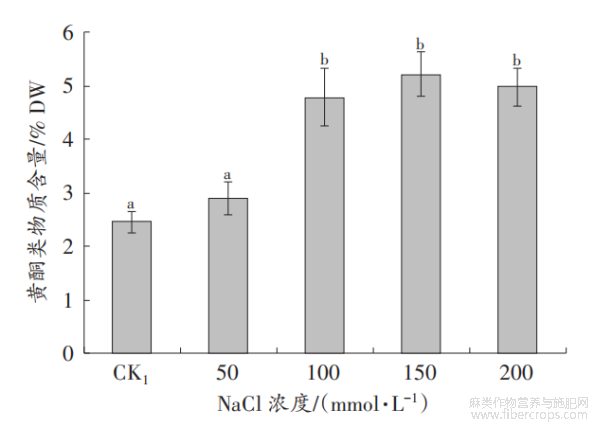
随着盐浓度的增加,罗布麻叶片中黄酮类物质的含量总体呈增高趋势,表明盐胁迫可诱导罗布麻叶片中黄酮类物质的合成。当NaCl浓度为100~200mmol/L时,罗布麻叶片中黄酮类物质的含量与CK1差异达到显著水平(P<0.05)。其中,在150mmol/LNaCl胁迫下,黄酮类物质的含量最高(图2)。因此,选取150mmol/LNaCl作为盐胁迫浓度开展外源施用SNP试验。
图2 盐胁迫对罗布麻叶片中黄酮类物质含量的影响
2.2外源SNP对罗布麻叶片生物量积累速率的影响
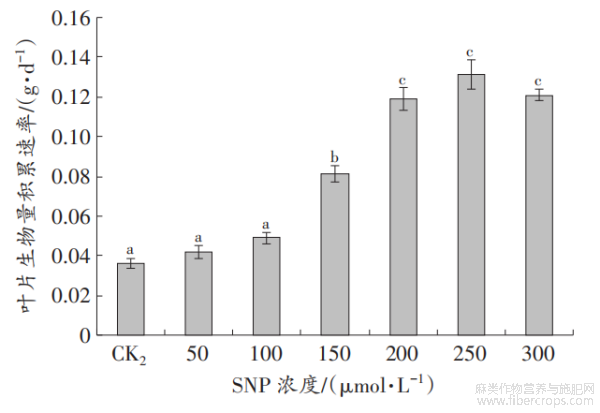
由图3可以看出,在150mmol/LNaCl胁迫处理下,施加不同浓度的SNP可以不同程度地提高罗布麻叶片的生物量积累速率。其中,当SNP浓度达到150~300μmol/L时,罗布麻叶片的生物量积累速率与CK2之间差异达到显著水平(P<0.05),以250μmol/LSNP处理罗布麻叶片的生物积累速率最高。故以下试验选用250μmol/LSNP作为外源NO处理浓度。
图3 SNP对盐胁迫下罗布麻叶片生物量积累速率的影响
2.3 NO对盐胁迫下罗布麻叶片PAL活性的影响
苯丙氨酸解氨酶(PAL)作为苯丙烷代谢途径的关键酶之一,对黄酮类物质合成起关键作用。由图4可以看出:盐胁迫第8天时,SNP处理罗布麻叶片PAL活性升高,但与CK3差异不显著;SNP+NaCl处理促进了罗布麻叶片PAL活性的增加,达到180.6nmol/(mg·h),显著高于其他处理(P<0.05);NaCl处理罗布麻叶片PAL活性为141.1nmol/(mg·h),与CK3差异显著(P<0.05);SNP处理罗布麻叶片PAL活性较CK3有一定程度的升高,但差异不显著;SNP+NaCl+HG处理罗布麻叶片PAL活性较CK3升高,但较SNP+NaCl处理显著降低(P<0.05)。说明SNP来源的NO促进了盐胁迫下罗布麻叶片PAL活性的升高。
图4 不同处理罗布麻叶片PAL活性
2.4 NO对盐胁迫下罗布麻黄酮类物质的影响
在150mmol/LNaCl胁迫处理下,外源施加SNP处理第4天时,罗布麻叶片中黄酮类物质含量开始增加;第12天时,黄酮类物质为单独盐胁迫处理的131%。由图5可以看出:SNP处理罗布麻叶片中黄酮类物质的含量较CK3略有升高,差异不显著;HG处理罗布麻叶片中黄酮类物质的含量没有提高;SNP+NaCl处理罗布麻叶片中黄酮类物质含量最高,与其他处理差异均达到显著水平(P<0.05);SNP+NaCl+HG处理罗布麻叶片中黄酮类物质含量显著高于CK3(P<0.05),但较SNP+NaCl处理显著降低(P<0.05)。说明血红蛋白和SNP协同处理时降低了盐胁迫下SNP对黄酮物质合成的促进作用,同时也说明盐胁迫下罗布麻黄酮类物质的促进作用是通过SNP来源的NO介导的。
图5 不同处理罗布麻叶片中黄酮类物质含量
3结论与讨论
近年来,许多研究表明,NO广泛参与植物抗生物和非生物胁迫应答,如抗盐碱、耐干旱、抗病等[10-12]。另外,NO也广泛参与一些药用植物的次生代谢产物的合成,说明NO可能是通过诱导植物次生代谢产物的合成来提高植物抵抗逆境胁迫的能力[6,13]。本研究结果表明:盐胁迫可诱导罗布麻黄酮类物质的合成;在盐胁迫的同时再施用外源NO供体SNP,罗布麻叶片生物量积累速率、PAL活性、黄酮类物质含量等均显著高于单独盐胁迫时的各项指标。在SNP协同盐胁迫条件下施用NO清除剂血红蛋白,可以降低SNP协同盐胁迫对罗布麻叶片PAL活性、黄酮类物质合成的促进作用。这些结果表明,SNP来源的NO介导了盐胁迫下罗布麻次生代谢物质合成。
NO对盐胁迫下罗布麻叶片中黄酮类物质合成的促进作用可能是由于NO介导了罗布麻对盐胁迫的系统性防御反应。已有一些研究发现,逆境胁迫诱导植物NO产生增加,NO又介导植物细胞壁组成物质木质素等的合成,同时NO也参与逆境胁迫下次生代谢产物的合成,这样通过细胞壁组成物质合成的增加和次生代谢产物的增加来缓解盐碱、干旱、病原物等逆境胁迫对植物的伤害作用,如NO参与烟草、水稻、拟南芥等植物在盐碱和病原物胁迫下的防卫反应[7,14-15]。推测在NaCl胁迫下,SNP来源的NO通过诱导罗布麻PAL活性升高来提高黄酮类物质的产生,调节渗透压,从而缓解盐胁迫的伤害。这与郝岗平等[2]在银杏上和杨秀红等[16]在药用植物甘草上的研究结果相似,干旱胁迫下NO诱导的银杏黄酮和盐胁迫下NO诱导的甘草酸的作用类似于渗透调节物质,抵抗干旱和盐碱等逆境胁迫。
参考文献
[1]FATMAM,MASOODA,PER T S,et al. Interplay between nitric oxide and sulfur assimilation in salt tolerance in plants [J].The Crop Journal,2016,4(3):153-161.
[2]郝岗平,杜希华,史仁玖 .干旱胁迫下外源一氧化氮促进银杏可溶性糖?脯氨酸和次生代谢产物合成[J].植物生理与分子生物学学报,2007,33(6):499-506.
[3]UCHIDA A,JAGENDORF A T,HIBINO T,et al. Effects of hydrogen peroxide and nitric oxide on both salt and heat stress tolerance in rice[J].Plant Science,2002,163(3):515-523.
[4]ZHANG Y Y,WANG L L,LIU Y L,et al. Nitric oxide enhances salt tolerance in maize seedlings through increa-sing activities of proton-pump and Na+/H+ antiport in the tonoplast[J].Planta,2006,224(3):545-555.
[5]HAJBAGHERI S,ABBASPOUR H,ENTESHARI S,et al. An investigation intothe effects of cadmium and nitric oxide on induced secondary metabolism and antioxidant system in Pimpinella anisum L. through transcriptional upregulations in AIS1,PAL,SOD,R2R3-MYB,and bZIP genes[J].Journal of Medicinal Plants and By-products,2022(1):129-134.
[6]REZAYIAN M,ZARINKAMAR F. Nitric oxide,calmodulin and calcium protein kinase interactions in the response of Brassica napus to salinity stress[J]. Plant Biology,2023,25(3):411-419.
[7]徐茂军,董菊芳,张刚 . NO 对金丝桃悬浮细胞生长及金丝桃素生物合成的促进作用研究[J].生物工程学报 ,2005,21( 1):66-70.
[8]KAMATA K,SEO S,NAKAJIMA J I. Constituents from leaves of Apocynum venetum L[J]. Journal of Natural Medi-cines,2008,62(2):160-163.
[9]SHAO Y,GAO G,ABUBAKAR A S,et al. Total flavonoids extracts of Apocynum L. from the Ili River valley region at different harvesting periods and bioactivity analysis[J]. Molecules,2022,27(21):7343.
[10]ZHAO L Q,ZHANG F,GUO J K,et al. Nitric oxide functions as a signal in salt resistance in the calluses from two ecotypes of reed[J]. Plant Physiology,2004,134(2):849-857.
[11]ZHOU B Y,GUO Z F,XING J P,et al. Nitric oxide is involved in abscisic acid-induced antioxidant activities in Stylosanthes guianensis[J]. Journal of Experimental Bo-tany,2005,56(422):3223-3228.
[12]BHARDWAJ S,KAPOOR D,SINGH S,et al.Nitric oxide: a ubiquitous signal molecule for enhancing plant tolerance to salinity stress and their molecular mechanisms[J]. Journal of Plant Growth Regulation,2021,40(6):2329-2341.
[13]郝岗平,杜希华,史仁玖.NO对银杏悬浮细胞生长及黄酮类物质合成的影响[J].西北植物学报 ,2007,27(2):272-277.
[14]DELLEDONNE M,ZEIER J,MAROCCO A,et al. Signal interactions between nitric oxide and reactive oxygen intermediates in the plant hypersensitive disease resis-tance response[J]. Proceedings of the National Academy of Sciences of the United States of America,2001,98(23):13454-13459.
[15]HU X Y,NEILL S J,CAI W M,et al.NO-mediated hyper-sensitive responses of rice suspension cultures induced by incompatible elicitor[J].Chinese Science Bulletin,2003,48(4):358-363.
[16]杨秀红,李建民,董学会,等.外源甘草酸对NaCl胁迫条件下甘草幼苗生长?根部甘草酸含量以及几种与盐胁迫相关生理指标的影响[J].植物生理学通讯,2006,42(3):441-444.
文章摘自:赵法兴,郝岗平.盐胁迫下外源一氧化氮对罗布麻叶片中黄酮类物质合成的影响[J].现代农业科技,2024(08):43-46.