摘 要:SBP (Squamosa promoter binding protein)是一类植物特有的转录因子,广泛参与植物的生长发育、次级代谢及形态建成等过程。为探究工业大麻SBP基因功能,本研究利用NCBI、ExPASy等网站及Tbtools、MEGA等软件对CsSBPs家族成员进鉴定和分析。结果显示,工业大麻基因组中共有16个SBP基因,不均匀的分布在7条染色体上,根据染色体定位信息命名为CsSBP1~CsSBPP16,理化性质分析显示,工业大麻SBP家族成员氨基酸数目在171~1053aa之间,相对分子量为19.12~116.71kD,等电点介于5.98~9.57之间;对拟南芥、水稻和工业大麻SBP蛋白进行聚类分析,51个SBP蛋白被分为11个亚组,16个CsSBPs分布于7个亚组中;在CsSBPs基因启动子区域检测到多个顺式作用元件,包含光响应、激素诱导元件、逆境响应元件以及MYB结合位点,这暗示CsSBPs家族成员可能通过多种途径影响工业大麻的生长发育及逆境应答过程。
关键词:工业大麻;SBP 转录因子;生物信息学分析
大麻(Cannabis sativa L.)为大麻科(Cannabinaceae)、大麻属(Cannabis Linn.)一年生草本植物,是传统药物和纺织纤维的重要来源,在中国有着悠久的栽培历史(车野等,2022)。按照国际规定,具有精神活性的毒性成分四氢大麻酚(tetrahydrocannabionl,THC)含量低于0.3%则被称为工业大麻(赵浩含等,2020)。由于工业大麻所含THC含量极低,已不具备毒品利用价值,使其在医药、食品、纺织等领域的经济利用价值得到充分挖掘与发挥(张晓艳等,2020)。目前,在中国云南、黑龙江两省已经实现工业大麻种植加工合法化。
大麻素是大麻植物特有的次生代谢物质,截止目前,已经分离鉴定出至少115种大麻素(王椿清等,2022)。大麻素的种类不同,精神活性差异较大。相较于THC,大麻二酚(cannabichromene,CBD)不具精神活性和依赖性,其相关制品也具有更高的安全性(Boggs et al.,2018)。相关研究证实,CBD能够治疗多种人类疾病,如调解免疫、止痛、镇静等(Stasi?owicz et al.,2021)。但高CBD的工业大麻品种在中国十分匮乏,且工业大麻多为雌雄异株异花授粉作物,天然杂交率较高,在使育种工作量提高的同时也提升了育种难度。因此,应进一步在分子水平上解析工业大麻生长发育特性及遗传作用机理,为工业大麻种质资源创新提供新思路、新路径。
SBP (Squamosa promoter binding protein)基因家族是一类植物特有的转录因子,由于能够识别并结合MADS-box基因SQUAMOSA(SQUA)启动子而被命名(Huijser et al.,1992),该家族基因广泛参与植物的生长发育及形态建成(Gou et al.,2011)。如最先在金鱼草中被发现并克隆的SBP1和SBP2基因,在花序形成和发育过程中表达量增加(Preston and Hileman,2010; Shao et al.,2019);拟南芥中,AtSPL8参与调控花粉囊的发育(Xing et al.,2013),过量表达AtSPL9和AtSPL10均可以延长间隔期,降低叶片生成速率,最终导致叶片数量减少,叶面积增加(Wang et al.,2008)。目前,在拟南芥(Cardon et al.,1999)、水稻(Xie et al.,2006)、葡萄(崔梦杰等,2018)、苹果(张晓辉,2014)、大豆和蒺藜苜蓿(李月颖等,2017)等多种植物中鉴定到SBP转录因子。但关于工业大麻中SBP家族基因的分析及研究均未见报道。本研究利用生物信息学方法对工业大麻SBP基因家族进行全基因组鉴定,并对其基因结构、染色体定位、顺式作用元件、系统进化进行分析,为进一步研究工业大麻SBP家族基因功能奠定基础。
1结果与分析
1.1大麻SBP基因的鉴定和理化性质分析
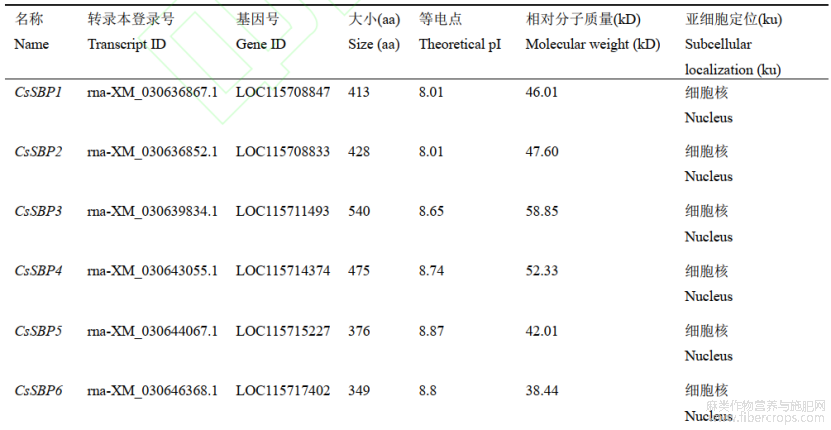
大麻全基因组共鉴定获得大麻SBP基因16个,理化性质分析显示,CsSBPs基因编码的氨基酸数量在171(CsSBP7/10)~1053(CsSBP16)aa之间;相对分子量为19.12(CsSBP7)~116.71(CsSBP 16)kDa;等电点在5.98(CsSBP15/14)~9.57(CsSBP10);亚细胞定位分析显示:CsSBP3定位于叶绿体,CsSBP12和CsSBP13定位于细胞质膜外,推测两者在功能上更为接近,其余CsSBPs均定位于细胞核(81.25%),表明该家族基因主要在细胞核内发挥功能。
表1 CsSBPs基因及编码蛋白的基本特征
图1 工业大麻SBP基因在染色体上的位置
1.2拟南芥、水稻与工业大麻SBP家族蛋白聚类分析
为进一步阐明工业大麻SBP家族成员间的系统进化关系,本研究以模式植物拟南芥、水稻和工业大麻SBP蛋白进行聚类分析(图2)。结果显示,51个SBP家族成员分为11个亚组(Group1~11),其中Group2、3、6、10中均没有工业大麻SBP家族基因分布,Group11中有7个CsSBP成员,数量最多。除CsSBP16独立形成分支外,其他CsSBP基因多与拟南芥SBP蛋白同处一个分支,这表明两者亲缘关系更近。
图2 拟南芥,水稻,工业大麻SBP家族成员系统进化树
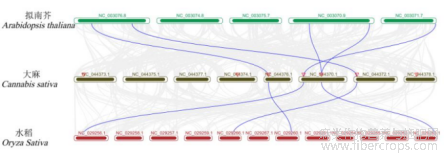
1.3工业大麻SBP基因的共线性分析
为进一步了解大麻SBP基因的进化机制,体用TBtools构建了大麻与拟南芥、水稻的SBP家族共线性关系图谱(图3),工业大麻与拟南芥有5对同源基因,与水稻有4对同源基因。这与系统进化分析的结果一致。
图3 拟南芥,水稻和工业大麻SBP基因共线性分析
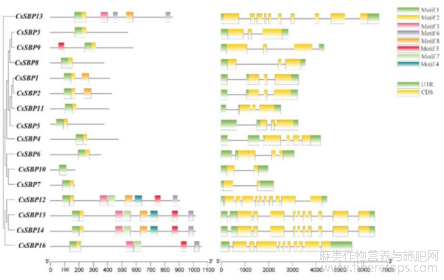
1.4工业大麻SBP基因结构及Motif分析
利用Tbtools中Gene structure view程序对工业大麻SBP家族的进化关系、Motif、UTR、CDS进行可视化分析(图4)。结果显示,16个工业大麻SBP蛋白序列共鉴定出8种不同的保守基序,除CsSBP10外的15个CsSBPs基因均含有Motif 1 (Zn-1结构+部分Zn-2);除CsSBP10外,其余成员均具有Motif 2部分(部分Zn-2+NLS);另外,在CsSBP12、CsSBP15、CsSBP14的N-端所含的Motif结构相同,这与蛋白聚类结果一致;CsSBP13中含有两个Motif 6。所有家族成员均含有内含子,数目为2~10个。
图4 CsSBPs基因结构及Motif
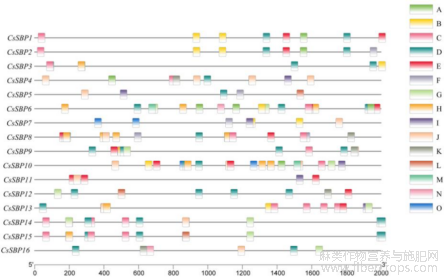
1.5工业大麻CsSBP家族基因启动子顺式作用元件分析
以工业大麻SBP家族基因转录起始位点ATG上游2000 bp作为启动子区进行顺式作用元件预测分析,并利用Tbtools进行可视化。结果显示,家族成员除包含必须的CAAT-box、TATA-box核心元件外,还包含多个与非生物胁迫相关的的顺式作用元件,如低温、干旱、厌氧诱导等。此外还有多种激素类响应元件,如赤霉素、脱落酸、茉莉酸甲酯、水杨酸及生长素等。在CsSBP5、CsSBP12、CsSBP14、CsSBP15中还含有参与类黄酮合成基因调控元件,此外,CsSBP1与CsSBP2及CsSBP14与CsSBP15两对基因可能由于进化关系较近,所含顺式作用元件也基本一致。
图5 大麻CsSBPs基因启动子区顺式作用元件
注: A: MYB结合位点-参与干旱诱导; B: 赤霉素响应元件; C: 低温响应元件;D: 厌氧诱导响应元件; E: 防御与胁迫应答元件; F: 生长素响应元件; G: 茉莉酸甲酯响应元件; H: 脱落酸响应元件; I: 水杨酸响应元件; J: 光响应元件; K: 调控分生组织表达的元件; L: MYB结合位点-参与类黄酮生物合成; M: 厌氧诱导增强子元件; N: MYB结合位点-参与光响应; O: 参与生长素的顺式作用元件
2讨论
转录调控是植物生长发育过程中非常重要的调控方式之一,转录因子可以通过靶向作用于下游基因启动子区的顺式作用元件,来控制下游基因的表达,参与逆境应答和生长发育(王超群等,2019)。随着科学技术的不断进步,越来越多的转录因子被发现与研究。SBP转录因子是一类植物特有的重要转录因子,在植物生长发育、逆境响应以及次级代谢等过程中发挥重要调控作用。
本研究首次利用生物信息学方法,在大麻基因组中筛选鉴定出16个CsSBP家族成员,16个成员不均匀的分布在7条染色体上。拟南芥、水稻和大麻SBP家族基因聚类分析显示,51个SBP蛋白被分为11个亚组(Group1-11),CsSBPs分布于7个亚组中(Gruop1,4,5,7,8,9,11),其中Group11中分布的大麻SBP蛋白最多。值得关注的是CsSBP16单独聚为一类,这暗示其生物学功能与其他成员可能有所差异。Motif分析显示该家族成员除CsSBP10外的所有成员均含有Motif 1和Motif 2,说明CsSBPs具有一定程度的保守性。研究基因启动子的结构、功能和作用机制一直是解析基因调控模式和信号传递途径的有效途径之一(李濯雪等,2015)。在16个工业大麻SBP基因家族成员的启动子区域检测到多个顺式作用元件,包含多个光响应元件、激素诱导元件、逆境响应元件以及MYB结合位点,表明CsSBPs家族成员可能参与大麻光周期变化、生长发育和逆境响应,并介导多种激素。这与银杏(苌棒,2021)、谷子(杜晓芬等,2021)、杜仲(韦德兰等,2022)的研究结果一致。
本研究通过生物信息学方法对工业大麻SBP家族转录因子进行全基因组鉴定,对染色体定位、基因结构、保守基序及顺式作用元件进行预测分析,以期为工业大麻分子育种提供理论基础,但目前该家族基因功能尚未解析,仍需进一步深入研究。
3材料与方法
3.1工业工业大麻SBP基因的鉴定
从NCBI (https://www.ncbi.nlm.nih.gov/)数据库下载工业大麻基因组序列文件、基因组注释文件。以拟南芥SBP蛋白序列作为参考序列,利用TBtools软件进行双向BLAST比对,删除重复项,再利用NCBI protein blast功能对所获得的SBP基因家族序列进行进一步的鉴定和确认。利用ExPASy在线工具与CellPLoc 2.0,分析预测工业大麻SBP基因家族成员的氨基酸数目、分子量、等电点及亚细胞定位信息。
3.2工业大麻SBP家族基因的染色体定位分析
通过工业大麻基因组GFF注释文件,获得CsSBPs基因的位置信息,利用Tbtools软件进行染色体定位可视化。
3.3工业大麻SBP基因家族聚类分析
下载拟南芥和水稻两个物种的SBP蛋白序列,利用Clustal W软件进行工业大麻与拟南芥、水稻SBP家族蛋白的多序列比对,采用MEGA-X最近邻接法(nearest Nneighbor interactions, NNI)进行聚类分析,利用在线网站iTOL (http://itol.embl.de)进行美化。
3.4工业大麻SBP家族蛋白保守结构域和基因结构分析
利用MEGA-X(最近邻接法)为工业大麻SBP家族蛋白序列构建系统发育进化树;以工业大麻基因组数据为基础,使用Tbtools分析工业大麻SBP基因家族的内含子-外显子结构;采用MEME在线网站获得Motif分析数据。利用Tbtools的Gene Structure View (advanced)工具将上述分析进行可视化。
3.5工业大麻SBP基因启动子顺式作用元件分析
利用Tbtools提取大麻SBP家族基因起始密码子ATG上游2 000 bp序列,通过PlantCARE在线程序获取其顺式作用元件分布情况,并利用Tbtools进行可视化。
参考文献
[1] Boggs D.L., Nguyen J.D., and Morgenson D., 2018, Clinical and preclinical evidence for functional interactions of cannabidiol and Δ9-tetrahydrocannabinol, Neuropsychopharmacology, 43(1): 142-154.
[2] Cardon G., Ho¨hmann S., Klein J., Nettesheim K., Saedler H., and Huijser P., 1999, Molecular characterisation of the Arabidopsis SBP-box genes, Gene, 237(1): 91-104.
[3] Chang B., 2021, Bioinformatics analysis of Ginkgo SBP box gene family and functional research of GbSBP1/9/13, Thesis for M.S., Yangzhou University, Supervisor: Jin B., pp.12-36. (苌棒, 2021, 银杏SBP-box基因家族生物信息学分析及GbSBP1/9/13功能研究, 硕士学位论文, 扬州大学, 导师:金飚, pp.12-36.)
[4] Che Y., Guo L., Wang M.Z., Li Z.Y., Zhang L., Jiang Z.Y., and Jie S.Y., 2022, The development status and existing problems of industrial cannabis in China, Heilongjiang Nongye Kexue (Heilongjiang Agricultural Science), 339(9): 105-110. (车野, 郭丽, 王明泽, 李泽宇, 张玲, 姜泽宇, 接思源, 2022, 我国工业大麻发展现状及存在的问题, 黑龙江农业科学, 339(9): 105-110.)
[5] Cui M.J., Wang C., Leng X.P., Wu W.M., Tang W., Zhang W.Y., Zhu X.D., Jia H.F., Shen W.B., and Fang J.G., 2018, Bioinformatics analysis of the SBP-box transcription factor family in grapes and its response to hormone regulation of grape fruit ripening. Nanjing Nongye Daxue Xuebao (Journal of Nanjing Agricultural University), 41(3): 429-439. (崔梦杰, 王晨, 冷翔鹏, 吴伟民, 汤崴, 张文颖, 朱旭东, 贾海锋, 沈文飚, 房经贵, 2018, 葡萄SBP-box转录因子家族的生物信息学分析及其应答激素调控葡萄果实成熟的作用, 南京农业大学学报, 41(3): 429-439.)
[6] Du X.F., Han K.N., Li Y.X., Wang Z.L., Lian S.C., and Wang J., 2021, Expression analysis of SBP transcription factor family genes in foxtail millet, Shanxi Nongye Kexue (Shanxi Agricultural Science), 49 (12): 1474-1482. (杜晓芬, 韩康妮, 李禹欣, 王智兰, 连世超, 王军, 2021, 谷子SBP转录因子家族基因的表达分析, 山西农业科学, 49(12): 1474-1482.)
[7] Gou J.Y., Felippes F.F., Liu C.J., Weigel D., and Wang J.W., 2011, Negative regulation of anthocyanin biosynthesis in Arabidopsis by a miR156-Targeted SPL transcription factor, The Plant Cell, 23(4) : 1512-1522.
[8] Huijser P., Klein J., Lönnig W.E., Meijer H., Saedler H., and Sommer H., 1992, Bracteomania, an inflorescence anomaly, is caused by the loss of function of the MADS-box gene squamosa inAntirrhinum majus, The EMBO Journal, 11(4): 1239-1249.
[9] Li Y.Y., Li J., and Liu C.N., 2017, Genome wide analysis of SBP box transcription factor gene family inMedicago truncatula, Hunan Shifan Daxue Zirang Kexue Xuebao (Journal of Natural Science of Hunan Normal University), 40(6): 24-33, 95. (李月颖, 李菁, 刘长宁, 2017,蒺藜苜蓿SBP-box转录因子基因家族全基因组分析, 湖南师范大学自然科学学报, 40(6):24-33+95.)
[10] Li Z.X., and Chen X.B., 2015, Research progress on plant inducible promoters and related cis acting elements, Shengwu Jishu Tongbao (Biotechnology Bulletin), 31(10): 8-15. (李濯雪, 陈信波, 2015, 植物诱导型启动子及相关顺式作用元件研究进展, 生物技术通报, 31(10): 8-15.)
[11] Preston J.C., and Hileman L.C., 2010, SQUAMOSA-PROMOTER BINDING PROTEIN 1 initiates flowering inAntirrhinum majus through the activation of meristem identity genes, The Plant Journal, 62(4): 704-712.
[12] Shao Y.L., Zhou H.Z., Wu Y.R., Zhang H., Lin J., Jiang X.Y., He Q.J., Zhu J.S., Li Y., Yu H., and Mao C.Z., 2019, OsSPL3, an SBP-domain protein, regulates crown root development in rice, The Plant Cell, 31(6): 1257-1275.
[13] Stasi?owicz A., Tomala A., Podolak I., and Cielecka-Piontek J., 2021,Cannabis sativa L. as a natural drug meeting the criteria of a multitarget approach to treatment, Int. J. Mol. Sci., 22(2): 778.
[14] Wang C.Q., Liang Y.C., Chen S.L., Li M.Z., and Dong L.L., 2019. Molecular genetic mechanism of stress resistance in medicinal plants, Zhongguo Xiandai Zhongyao (Modern Chinese Medicine), 21(11): 1445-1455. (王超群, 梁乙川, 陈士林, 李孟芝, 董林林, 2019, 药用植物抗逆性反应的分子遗传机制研究, 中国现代中药, 21(11): 1445-1455.)
[15] Wang C.Q., Zhang Y.Y., Li Q., Du L.N., and Jin G.Y., 2022, Research progress on pharmacological effects and structure-activity relationships of common cannabinoids, Zhongguo Yaowu Jingjie (China Pharmacovigilance), 19(12): 1388-1392. (王椿清, 张圆圆, 李倩, 杜丽娜, 金光义, 2022, 常见大麻素类化合物药理作用及构效关系研究进展, 中国药物警戒, 19(12): 1388-1392.)
[16] Wang J.W., Schwab R., Czech B., Mica E. and Weigel D., 2008, Dual effects of miR156-targeted SPL genes and CYP78A5/KLUH on plastochron length and organ size inArabidopsis thaliana, The Plant Cell, 20(5): 1231-1243.
[17] Wei D.L., Zhang B.H., Yao X.Z., Liu Y.G., and Lü L.T., 2022, Identification of Eucommia ulmoides SBP box gene family and expression analysis under non Biotic stress, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 20(5): 1505-1513. (韦德兰, 张宝会, 姚新转, 刘洋, 吕立堂, 2022, 杜仲SBP-box基因家族鉴定及非生物胁迫下表达分析, 分子植物育种, 20(5): 1505-1513.)
[18] Xie K.B., Wu C.Q., and Xiong L.Z., 2006, Genomic organization, differential expression, and interaction of SQUAMOSA promoter-binding-like transcription factors and microRNA156 in rice , Plant Physiology, 142(1): 280-293.
[19] Xing S.P., Salinas M., Garcia-Molina A., Höhmann S., Berndtgen R., and Huijser P., 2013, SPL8 and miR156-targetedSPL genes redundantly regulate Arabidopsis gynoecium differential patterning, Plant Journal, 75(4): 566-577.
[20] Zhang X.H., Wei X.C., Li X.X., Sun Y.Y., Wang G., Chang Z.J., Liu G.Q., Qiu Y., Song J.P., Wang H.G., Shen D., Wang D.J., and Han Y.P., 2014, Apple genome wide SBP box gene family analysis and molecular cloning of representative members, Yuanyi Xuebao (Journal of Horticulture), 41(2): 215-226. (张晓辉, 魏小春, 李锡香, 孙玉燕, 王冠, 常兆晶, 刘冠群, 邱杨, 宋江萍, 王海平, 沈镝, 王大江, 韩月澎, 2014, 苹果全基因组SBP-box基因家族分析及代表成员的分子克隆, 园艺学报, 41(2): 215-226.)
[21] Zhang X.Y., Wang X.N., Cao K., and Sun Y.F., 2020, Correlation analysis of fiber yield and yield components of five industrial hemp varieties (strains), Zuowu Zazhi (Journal of Crops), (4): 121-126. (张晓艳, 王晓楠, 曹焜, 孙宇峰, 2020, 5个工业大麻品种(系)纤维产量及产量构成因素的相关性分析, 作物杂志, (4): 121-126.)
[22] Zhao H.H., Chen J.K., and Xiong H.P., 2020, Research on Innovative Development Strategies of China's Industrial Cannabis Seed Industry, Nongye Xiandaihua Yanjiu (Agricultural Modernization Research), 41(5): 765-771. (赵浩含, 陈继康, 熊和平, 2020,中国工业大麻种业创新发展策略研究, 农业现代化研究, 41(5): 765-771.)
文章摘自:杨威,车野,王明泽,等.工业大麻SBP家族转录因子全基因组鉴定及分析[J/OL].分子植物育种:1-8[2024-05-07].http://kns.cnki.net/kcms/detail/46.1068.S.20240423.1725.015.html.