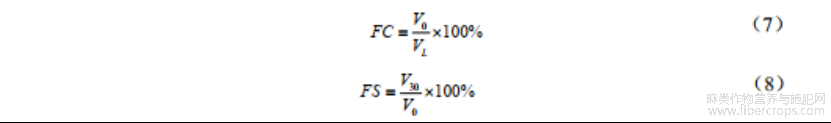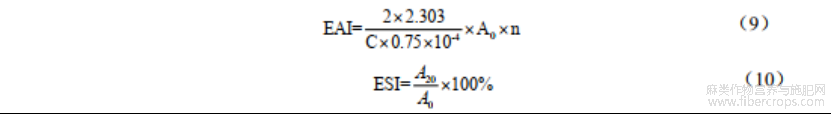摘 要:本文以菜籽饼和亚麻籽饼为原料,采用碱溶酸沉、乙醇浸提、酶解和盐析4种方法分离提取菜籽蛋白和亚麻籽蛋白,探讨不同提取方法对菜籽和亚麻籽蛋白品质特性的影响。结果表明:四种方法提取的菜籽蛋白和亚麻籽蛋白等电点均为4.4;乙醇浸提法提取的菜籽和亚麻籽蛋白提取率最高(分别为47.01%和48.19%),纯度最低;酶解法提取两种蛋白的纯度则高于其他三种方法,分别达89.30%和83.19%;盐析法提取的两种蛋白的加工功能特性更佳,其中溶解度分别为68.19%和64.90%,持水性分别为58.00%和40.33%,持油性分别为57.00%和35.83%,起泡性高达91.67%和89.29%,乳化性为71.38%和32.75%,乳化稳定性为32.75%和65.37%,同时酶解法提取的两种蛋白在溶解性、泡沫稳定性及乳化稳定性等特性与盐析法具有相似结果。该研究为菜籽和亚麻籽蛋白后续实际生产及加工应用提供了一定的参考依据。
关键词:菜籽蛋白;亚麻籽蛋白;碱溶酸沉法;乙醇浸提法;酶解法;盐析法
油菜籽和亚麻籽均为我国重要的油料作物,其饼粕作为植物油的加工副产物,具有较高的研究价值。菜籽饼粕中蛋白质含量约为35%-45%[1],亚麻籽饼粕中蛋白质含量约为15%-20%[2]。菜籽蛋白是一种全价蛋白,具有较高的营养价值,含有丰富的碱性氨基酸和含硫氨基酸,氨基酸组成与WHO/FAO推荐的氨基酸组成模式相近,营养价值等于或优于动物蛋白[3]。亚麻籽蛋白的氨基酸模式与大豆分离蛋白相似,富含天冬氨酸、谷氨酸等多种人体必需氨基酸,同时亚麻籽蛋白中必需氨基酸在总氨基酸含量中占比高于36%,具有良好的乳化性、持水性和起泡性等[4]。
目前,菜籽饼和亚麻籽饼主要被用作动物饲料、生物燃料等低价值产品,造成了较大的资源浪费。菜籽、亚麻籽等油料蛋白最常见提取方法有碱溶酸沉法、乙醇浸提法、酶解法、盐析法等,其中碱溶酸沉法应用最为广泛[5]。碱溶酸沉法可实现油料蛋白的重复提取,但存在提取获得的蛋白含量低、提取时间长、易导致蛋白质变性等问题。乙醇浸提法和盐析法则操作简单,提取时间短,且提取出的蛋白质含量较高。酶解法能使蛋白质最大限度保持结构稳定,对蛋白质的后续开发利用影响较小。国内外学者研究表明上述四种方法的蛋白质提取率在51.65%-78.47%[6,7,8]。翟晓娜等[9]对碱溶酸沉法提取菜籽粕蛋白进行了工艺优化,并表明菜籽粕蛋白具有良好的ABTS自由基清除及抑制金黄色葡萄球菌生长的能力。Karaca等[10]研究发现,碱溶酸沉法提取的亚麻籽蛋白与盐析法相比具有更高的溶解度和表面疏水性,而盐析法提取的亚麻籽蛋白具有更好的乳化性及其它加工特性。MinaTirgar[11]采用碱溶酸沉法、酶法和酶溶剂辅助法提取亚麻籽蛋白,结果表明碱溶酸沉法提取的蛋白质含量较低,但其具有最高的乳化性能。
本研究采用碱溶酸沉法、乙醇浸提法、酶解法和盐析法四种方法分别从菜籽饼和亚麻籽饼中分离提取蛋白,分别从理化特性、结构特性和功能特性三方面进行对比分析,明确不同提取方法对菜籽蛋白和亚麻籽蛋白品质特性的影响,以期为菜籽蛋白和亚麻籽蛋白资源的开发利用提供理论依据。
1 材料与方法
1.1材料与试剂
材料:菜籽和亚麻籽,产自青海互助。
试剂:氢氧化钠,优级纯;硼酸、盐酸、硫酸、硫酸铵、蔗糖、五水硫酸铜、硫酸钾、石油醚、丙酮,以上为化学纯。
1.2仪器与设备
XZ-YZ200液压榨油机,广州旭众食品机械有限公司;索氏抽提器,海能仪器;KQ-800D型台式医用数控超声波清洗器,科桥超声;CS55-9冷冻干燥机,基因有限公司;RF-530荧光分光光度仪、UV-1780紫外可见分光光度计、Nicolet-6700傅里叶红外光谱仪,岛津仪器有限公司;JSM-6610LV电镜扫描仪,日本Hitachi公司。
1.3试验方法
1.3.1菜籽饼及亚麻籽饼的制备
菜籽和亚麻籽除杂后,采用液压压榨法,在70℃条件下压榨得菜籽油和亚麻籽油,收集副产物菜籽饼和亚麻籽饼,将其粉碎,脱脂后备用。
1.3.2菜籽及亚麻籽蛋白的提取
碱溶酸沉法:分别称取8g脱脂菜籽饼和亚麻籽饼,按料液比1:30与蒸馏水混合均匀后,用0.1mol/L NaOH溶液调节pH值至9.5,50℃水浴1h后离心取上清液,加入0.1mol/L HCl溶液调节pH值至4.5,8000r/min离心10min后,真空冷冻干燥12h获得蛋白。
酶解法:分别称取8g脱脂菜籽饼和亚麻籽饼,按料液比1:30与蒸馏水混合均匀后,加入3%纤维素酶和4%α-淀粉酶,用0.1mol/L NaOH溶液调节蒸馏水pH值至6.0,,并在50℃条件下酶解4h后,在92℃条件下灭酶10min,8000r/min离心10min取上清液浓缩,真空冷冻干燥12h获得蛋白。
乙醇浸提法:分别称取8g脱脂菜籽饼和亚麻籽饼,按固液比1:8加入体积分数为70%的乙醇溶液,混合均匀,置于恒温振荡箱中,在50℃下振荡75min,后在-0.6kpa真空度下抽滤,滤粕浸提2次,真空冷冻干燥12h获得蛋白。
盐析法:分别称取8g脱脂菜籽饼和亚麻籽饼,同时配制0.17mol/L NaCl溶液,按料液比1:20与样品混合均匀后,用0.1mol/L NaOH调节pH至9.5,在50℃水浴60min,8000r/min离心10min,取其上清液透析48h后浓缩,真空冷冻干燥12h获得蛋白。
1.3.3菜籽及亚麻籽蛋白品质分析
1.3.3.1蛋白提取率及纯度测定
参照GB/T6432-2018,标准曲线的制备:将0、0.2、0.4、0.6、0.8、1.0mL的牛血清白蛋白标准液,分别用蒸馏水稀释到1.0mL,然后分别加入5mL的考马斯亮蓝溶液,充分搅拌5min后,在波长为595nm处测定其溶液的吸光值,蛋白含量按公式(1)计算。
取不同提取方法的菜籽蛋白和亚麻籽蛋白配制成10mg/mL的蛋白溶液,在400W,45℃条件下超声40min,8000r/min离心5min。取2mL上清液于10ml离心管中,避光加入5mL考马斯亮蓝溶液,反应5min后在595nm处测吸光值,分别按公式(2)(3)计算提取率及纯度。
1.3.3.2蛋白质理化特性测定
(1)等电点
将蛋白用pH10NaOH溶液以1:30比例溶解,依次调节pH为3.6、4.0、4.4、4.8、5.2,在8000r/min下离心10min,吸取1mL上清液于10.00mL离心管中,考马斯亮蓝法测定595nm处不同pH下蛋白液的吸光值,选择吸光值最小的pH为蛋白等电点。
(2)表面疏水性
分别称取10mg蛋白样品溶于磷酸盐缓冲溶液(浓度0.01mol/L、pH7.4),制备浓度为0.01、0.02、0.03、0.04、0.05mg/mL的蛋白样品溶液。取20.0μLANS溶液(1.0mmol/L)和5.0mL蛋白质溶液混合均匀,避光反应2min后迅速上机测定荧光强度,激发波长和发射波长分别为280nm和340nm,以蛋白质浓度为横坐标,荧光强度为纵坐标作图,得回归线性方程,直线斜率即为蛋白质表面疏水性指数(H0)。
1.3.3.3蛋白质结构表征
(1)二级结构
分别称取10mg蛋白样品,按1:100加入KBr进行研磨,研磨混合均匀后压片器压片,于傅里叶红外光谱仪中做全波段(400~4000cm-1)扫描,分辨率4cm-1,精度0.01cm-1,扫描次数为128次。
(2)三级结构
内源荧光光谱法:称取150mg蛋白样品,用磷酸盐缓冲液(0.01mol/L,pH=7.0)配制3mg/mL蛋白溶液,水析膜过滤除杂,使用5nm狭缝在激发波长295nm下记录300~500nm发射光谱。
紫外光谱法:称取150mg蛋白样品,用磷酸盐缓冲液(0.01mol/L,pH=7.0)配制3mg/mL蛋白溶液,水析膜过滤除杂,紫外分光光度计测定蛋白样液的吸光度,样品扫描波长范围为220-340nm。
(3)微观结构
电镜扫描法:分别称取10mg蛋白样品,用棉签蘸取不同方法提取出的蛋白样品,将其固定在载玻片上,喷金后于抽真空环境下进行观察,放大1000倍对蛋白样品微观结构进行扫描观察。
1.3.3.4蛋白质功能特性测定
(1)溶解度
配制10mg/mL的菜籽和亚麻籽蛋白溶液,8000r/min离心10min。取1mL上清液,加入5mL考马斯亮蓝溶液,避光充分反应5min后在595nm处测定其吸光值,溶解度按公式(4)计算:
(2)持水性
将10mL离心管恒重。称取0.5g蛋白样品记录为m0,将样品称入离心管中,记录重量为m1。加入10mL蒸馏水,室温静置30min,8000r/min离心10min后,将上清液的水去除,称离心管重量记为m2。持水性(WH)按公式(5)计算:
(3)持油性
将10mL离心管恒重。称取0.5g蛋白样品记录为m0,将样品称入离心管中,记录重量为m1。加入10mL大豆油,室温静置30min,8000r/min离心10min后,将上清液的油去除,称离心管重量记为m2。持油性(OH)按公式(6)计算:
(4)起泡性及泡沫稳定性
称取50mg蛋白样品,去离子水定容于50mL容量瓶中,配制成1mg/mL蛋白溶液。取15mL(VL)样品溶液于烧杯中,12000r/min均质2min,迅速测量起泡层高度(V0),静置30min后,测量泡沫高度(V30)。起泡性(FC)及泡沫稳定性(FS)通过以下公式计算:
(5)乳化性及乳化稳定性
取20mL1mg/mL的蛋白溶液以3:1比例与大豆油混合,7000r/min均质2min。从底部移取100μL溶液与50mLSDS溶液(pH7.0,0.1%)进行混合,紫外分光光度计在500nm波长下测定吸光值A0,静置20min后,重复上述操作,乳化活性(EAI)和乳化稳定性(ESI)计算公式如下:
1.4数据处理及统计
所有数据平行测定三次,结果取平均值,采用SPSS 26.0、Nicolet Omnic和PeakFit4.12软件对数据进行统计分析,Origin 2023作图。
2 结果与分析
2.1不同提取方法对蛋白提取率及纯度的影响
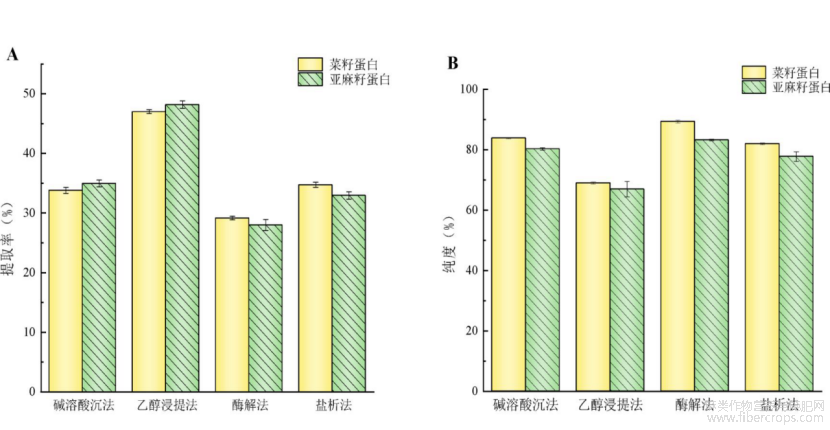
如图1A所示,乙醇浸提法提取菜籽蛋白和亚麻籽蛋白的提取率最高,分别为47.01%和48.19%,碱溶酸沉法和盐析法次之,酶解法提取效果较差,仅为29.16%和28.01%。如图1B所示,酶解法提取两种蛋白的纯度最高,分别为89.30%和83.20%,乙醇浸提法所得蛋白纯度最低分别为68.97%和66.93%。归因于不同提取方法对粕中其它成分(油脂、多糖和酚类化合物等)的去除效果不同,这些成分会影响蛋白质的溶解度和稳定性[12],其中乙醇浸提法受影响较大,由于其提取物以粗蛋白为主,含有大量杂质,因此提取率较高,而纯度较低。利用酶解法提取的两种蛋白虽具有较高的纯度,但其提取率偏低,可能是由于菜籽粕和亚麻籽粕在进行复合酶解时,产生了较多的黏液导致蛋白之间发生粘连,从而降低了蛋白的提取率[7]。
图1不同提取方法蛋白提取率及纯度(A-提取率;B-纯度)
2.2不同提取方法对蛋白质理化特性的影响
2.2.1等电点
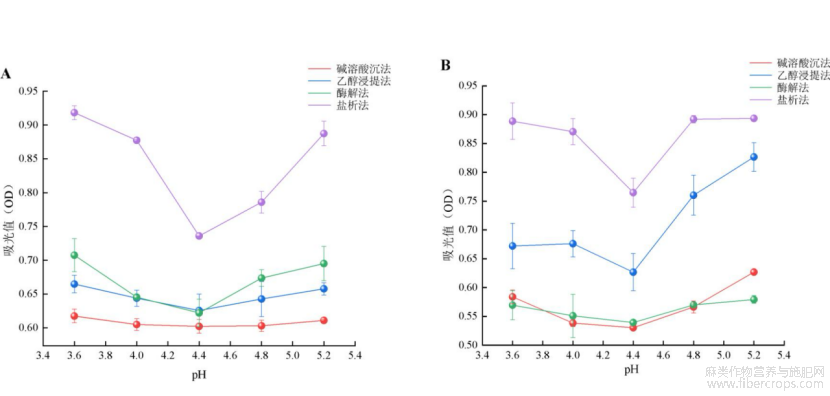
由图2可知,上清液中蛋白质含量随pH值的增大均呈先下降后上升的趋势,当pH=4.4时,上清液中的吸光值最低,表明此时菜籽蛋白和亚麻籽蛋白的溶解性最低,沉淀量达到最大,因此,四种提取方法所得菜籽和亚麻籽蛋白的等电点均为4.4。翟晓娜等[9]和施树[13]分别利用碱溶酸沉法提取菜籽蛋白和亚麻籽蛋白,测得等电点均为4.4。吴兴雨等[14]采用双酶复合法提取亚麻蛋白,测得其等电点也为4.4,均与本研究结果一致。不同提取方法制备的蛋白其等电点均一致,因此,不同提取方法对菜籽蛋白和亚麻籽蛋白的等电点几乎不产生影响。
图2不同提取方法蛋白质等电点(A-菜籽蛋白;B-亚麻籽蛋白)
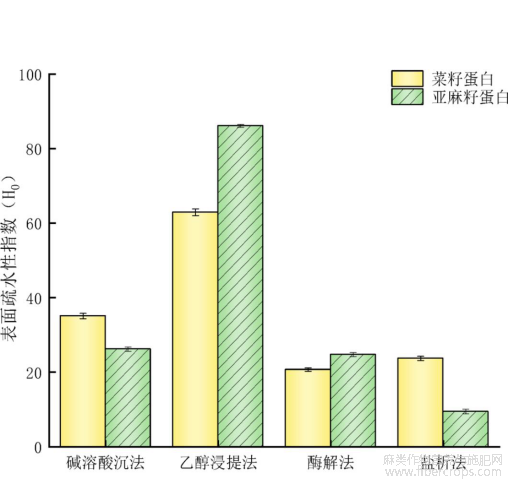
2.2.2表面疏水性
表面疏水性是衡量蛋白质功能性质的关键指标之一,对蛋白的品质特性具有较大影响[15]。不同提取方法对菜籽和亚麻籽蛋白表面疏水性的影响如图3所示,乙醇浸提法提取的菜籽蛋白和亚麻籽蛋白表面疏水性分别为62.93%和86.1%,显著高于其他三种方法,蛋白质表面疏水性主要取决于暴露在蛋白质分子表面的疏水性残基[16],产生这一结果的原因可能在于高浓度乙醇浸提过程中蛋白分子结构发生变化,增加了游离巯基的数量,使得蛋白分子的折叠程度降低,此时有较多的疏水性残基暴露在蛋白质分子表面,使得表面疏水性增加。
图3不同提取方法蛋白质表面疏水性
2.3不同提取方法对蛋白质结构的影响
2.3.1二观结构
如图4所示为不同提取方法下菜籽和亚麻籽蛋白二级结构含量变化及酰胺I带的拟合结果。由于酰胺I带吸收光谱(1600-1700cm-1)的改变是由蛋白质连接C=O键的拉伸振动所引起的,因此酰胺I带常被用于分析蛋白质二级结构的变化[17]。如图4A、4B所示,与碱溶酸沉法所提的菜籽蛋白和亚麻籽蛋白对比,乙醇浸提法、酶解法和盐析法所提取蛋白的波形均发生了红移,但每种方法红移的程度不同。乙醇浸提法红移的程度最小,酶解法次之,盐析法红移了约10cm-1,红移程度最大。由此可知,不同提取方法在提取过程中蛋白质二级结构受到了不同程度的影响,降低了结构的稳定性,原本的结构开始逐渐聚合。当氢键作用较强时,C=O的电子云密度逐渐降低,导致吸收峰位向高波数方向红移[11]。
图4不同提取方法蛋白质傅里叶红外光谱(A-菜籽蛋白;B-亚麻籽蛋白;C-F依次为碱溶酸沉、乙醇浸提、酶解和盐析法提取菜籽蛋白的酰胺I带拟合图;G-J依次为亚麻籽蛋白酰胺I带拟合图)
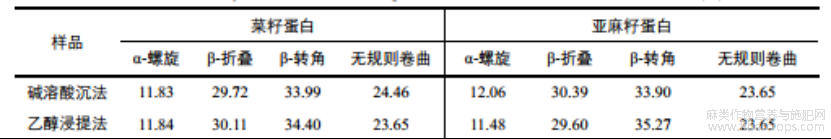
采用AzinSadat等[18]的分析方法,以1600-1639cm-1为β-折叠,1640-1650cm-1为无规卷曲,1651-1660cm-1为α-螺旋,1661-1700cm-1为β-转角作为定量指标来分析蛋白质的二级结构。如表1所示,碱溶酸沉、乙醇浸提、酶解和盐析法四种方法提取的菜籽蛋白中α-螺旋和β-折叠之和分别为41.55%、41.95%、42.01%和42.94%,亚麻籽蛋白中分别为42.45%、41.08%、40.75%和46.43%,两种蛋白的α-螺旋和β-折叠含量相对较低,表明其二级结构稳定性一般,可能是由于提取蛋白的过程中,不同的处理增加了蛋白分子的无序性,使结构更加疏松,因而降低了稳定性,由此可知,不同提取方法对蛋白的二级结构有一定的影响。此外,由于蛋白质分子中α-螺旋和β-折叠能够形成紧密的无空腔结构,相比于无规则卷曲具有更强的构象稳定性和紧密程度[19],则盐析法提取的两种蛋白具有相对更加稳定的二级结构。
表1不同提取方法蛋白的二级结构含量(%)
2.3.2三级结构
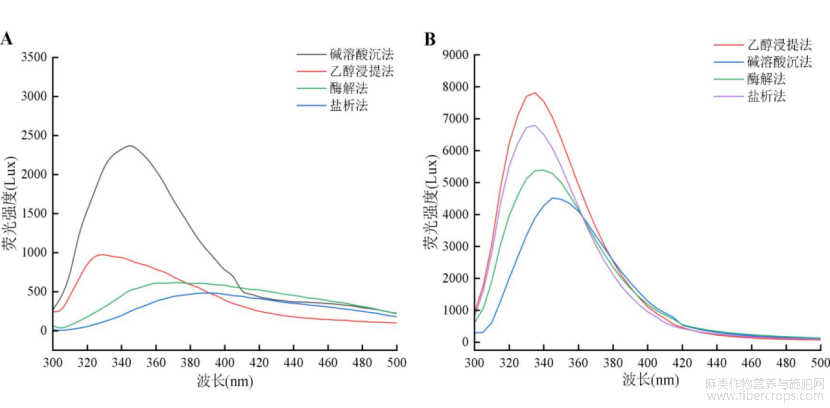
通过荧光光谱法可以获得蛋白质三级结构的信息。蛋白质中的色氨酸、酪氨酸和苯丙氨酸是产生内源荧光光谱的主要来源,三者均可在280nm激发波长下发射荧光,且色氨酸残基的最大发射波长在340nm左右[20]。如图5所示,不同提取方法下蛋白质的荧光强度具有一定差异,说明不同提取方法对蛋白质中芳香族氨基酸含量有一定影响。由图5A可知,碱溶酸沉法提取的菜籽蛋白荧光强度最高,而盐析法提取蛋白的荧光强度最低;图5B显示了乙醇浸提法提取亚麻籽蛋白荧光强度最高,而碱溶酸沉法提取蛋白荧光强度最低;荧光强度高说明蛋白的三级结构舒张程度最大,卷曲程度最低,荧光强度低则说明蛋白空间构象较紧密,游离的色氨酸、酪氨酸很少,蛋白构象内不同多肽链间卷曲程度最大,分子间碰撞产生更多交联反应,引起更多的荧光猝灭[21]。
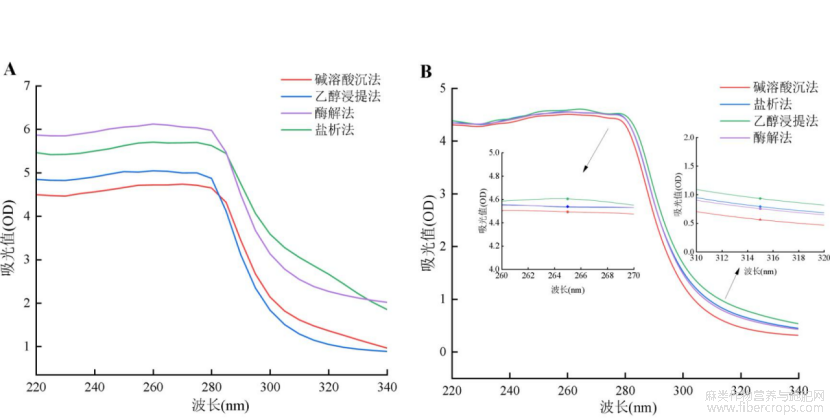
蛋白质的紫外吸收强度与蛋白质侧链上的芳香族氨基酸紧密相关,它们在蛋白质中的存在数量与蛋白质的紫外吸收强度呈正比关系。由图6可知,四种提取方法下两种蛋白质的最大紫外吸收波长为340nm左右,这反映了菜籽和亚麻籽蛋白的紫外吸收主要是由于其蛋白内的色氨酸和酪氨酸残基引起的。四种提取方法下的紫外吸光值的趋势基本一致,而吸光值又各不相同,这说明四种蛋白质侧链上的色氨酸、酪氨酸和苯丙氨酸的数量很相近但又不同,通过碱溶酸沉法所得两种蛋白的吸光值最低,产生这种结果的原因可能在于不同的提取方法导致蛋白质构象发生改变,此结果与荧光光谱结果一致,进一步证明了不同提取方法对蛋白的三级结构有一定的影响。
图5不同提取方法蛋白质荧光光谱图(A-菜籽蛋白;B-亚麻籽蛋白)
图6不同提取方法蛋白质紫外光谱图(A-菜籽蛋白;B-亚麻籽蛋白)
2.3.3微观结构
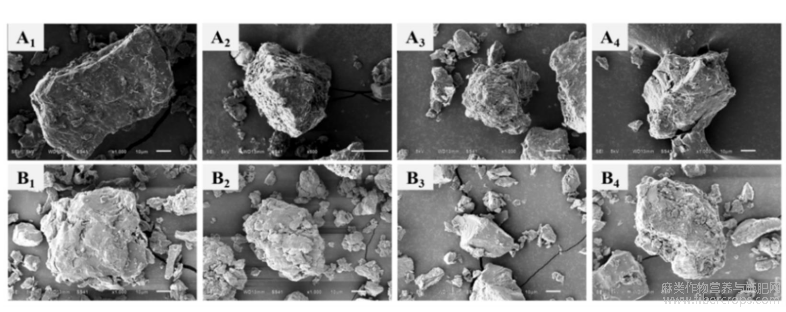
蛋白质的微观结构反应了蛋白质分子的聚集状态,对蛋白质的品质特性差异有重要影响,不同提取方法下菜籽和亚麻籽蛋白微观结构如图7所示,4种提取法所制备的蛋白颗粒大小不一,当放大1000倍后,不同方法提取的两种蛋白表面均有不同程度的破坏,由于分子间相互作用力,蛋白的聚合程度及分子间连接紧密度不一样[22]。乙醇浸提法和酶解法提取的菜籽蛋白,结构疏松,颗粒表面粗糙;而盐析法提取的菜籽蛋白,其空间结构较为连续,块状表面有些许蜂窝与孔洞,对其结构影响较小。通过碱溶酸沉法和乙醇浸提取的亚麻籽蛋白呈现出不规则的多边形状,并呈分散状态,片状或大块的颗粒分布较多,且颗粒表面粗;酶解法制得的蛋白颗粒普遍较小,颗粒表面较光滑,说明酶解对蛋白质的破坏较小;盐析法提取出的蛋白颗粒不一,相对来说比较聚集,但颗粒表面细小颗粒很多,说明破坏程度较大,这也证明盐析法对蛋白质的微观结构造成了较大的影响。从四种蛋白质的物理形态来看,蛋白质微观结构都发生了一定变化,菜籽和亚麻籽蛋白多空疏松的空间结构,使其形成了良好的亲水性,提高了蛋白质的整体持水能力和结合能力。
图7不同提取方法蛋白质扫描电镜图(A1-A4依次为碱溶酸沉、乙醇浸提、酶解和盐析法提取的菜籽蛋白;B1-B4-依次为亚麻籽蛋白)
2.4不同提取方法对蛋白质加工特性的影响
2.4.1溶解度
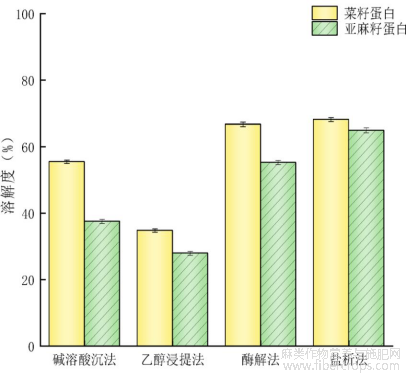
蛋白质溶解度是指蛋白质分子和水分子之间发生相互作用的综合结果,通常认为溶解度受到许多因素的影响[23]。如图8所示为不同方法制备菜籽和亚麻籽蛋白溶解度的结果,通过盐析法提取的两种蛋白溶解度最高(分别为68.19%和64.90%),其次是酶解法(66.72%和55.23%)和碱溶酸沉法(55.44%和37.54%),最低的是乙醇浸提法(34.78%和27.95%)。碱溶酸沉法和乙醇浸提法提取溶解度较低可能是由于蛋白样品在乙醇溶液及强酸强碱处理下发生了变性,失去了可溶性且结构变得松散,暴露出更多的疏水基团,导致样品溶解度降低[24]。此外,菜籽蛋白和亚麻籽蛋白中的其他组分如脂肪、纤维等也会一定程度上影响其溶解特性。吴兴雨等[14]通过酶解法和碱溶酸沉法提取亚麻蛋白,结果显示酶解法提取的亚麻籽蛋白的溶解性显著高于碱溶酸沉法,与本研究结果一致。
图8不同提取方法蛋白质溶解度
2.4.2持水性及持油性
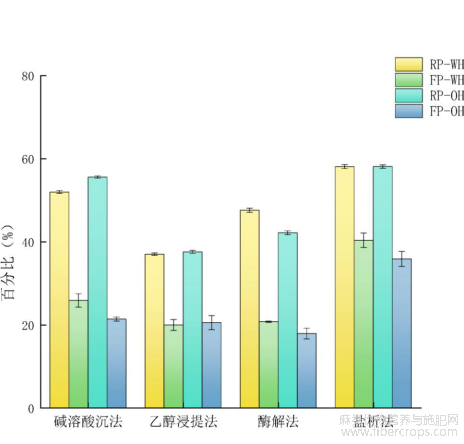
蛋白质持水性和持油性的高低能够直接影响产品的风味、质地和组成状态,与产品储藏过程中的保鲜保形有着密不可分的关系[25]。不同方法制备的菜籽和亚麻籽蛋白的持水性和持油性如图9所示,通过盐析法制备的两种蛋白持水性和持油性均为最高,其中菜籽蛋白持水性和持油性分别为58.00%和57.00%,亚麻籽蛋白的持水性和持油性分别为40.33%和35.83%。通过盐析法制备的两种蛋白结构中能与水和酯类结合的氨基酸含量较高,因此具有较高的持水性和持油性,而乙醇浸提法提取蛋白时,在高浓度乙醇的作用下,蛋白所含极性氨基酸的数量增加,非极性氨基酸的数量减少[5],导致持水性和持油性降低。
图9不同提取方法蛋白质持水性及持油性
2.4.3起泡性及泡沫稳定性
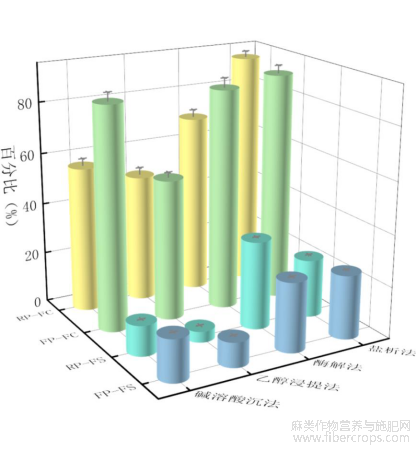
蛋白质泡沫是蛋白质液体薄膜包裹气泡的两相体系,评价蛋白质发泡特性的主要指标包括起泡量(FC)和泡沫稳定性(FS)。如图10所示为不同方法提取的菜籽蛋白和亚麻籽蛋白起泡性及泡沫稳定性的结果,由图10可知,盐析法提取的菜籽蛋白和亚麻籽蛋白的起泡性高达91.67%和89.29%,而乙醇浸提法提取的两种蛋白的起泡性较差,仅有49.77%和54.78%。结果表明盐析处理使蛋白质分子的肽链受到外界环境的干扰,增强了分子柔性,提升了蛋白质向气-水界面运动的效率,因此使得其起泡性有一定改善[5]。通过酶解法提取的菜籽蛋白和亚麻籽蛋白则具有较好的泡沫稳定性,分别为34.31%和27%。酶解处理增加了蛋白的表观黏度,从而抑制泡沫析出,提高泡沫稳定性[26]。此结果也与蛋白质的溶解度有关,较高的溶解性可以提高其吸附并扩散在空气和水界面中的能力,降低界面张力,从而促进了蛋白泡沫的形成,通过分子内和分子间的相互作用力,形成二维保护网络,维持泡沫的稳定。
图10不同提取方法蛋白质起泡性及泡沫稳定性
2.4.4乳化性及乳化稳定性
蛋白质乳化性是指蛋白与水油作用形成乳状物的能力,乳化稳定性是指该乳状物维持稳定存在的能力,通常利用乳化活性指数(EAI)和乳化稳定性(ESI)来评价蛋白质的乳化性能。如图11所示为不同方法提取的菜籽和亚麻籽蛋白乳化性和乳化稳定性的对比结果,其中盐析法提取的菜籽蛋白乳化性(71.38%)和乳化稳定性(32.75%)较好。其他三种方法提取菜籽蛋白的乳化性及乳化稳定性与蛋白的溶解度呈正相关,这是因为溶解度大的蛋白质,其分子向水油界面的扩散速度更快,利于分散体系的快速形成[27]。通过酶解法和盐析法提取的亚麻籽蛋白的乳化性和乳化稳定性结果差异较小,其中乳化性分别为32.06%和32.75%,乳化稳定性分别为65.56%和65.37%。孙雪等[25]研究表明蛋白质的乳化性能与其氨基酸组成、电荷分布、分子大小以及构象有关,因而说明不同提取方法对蛋白品质特性产生了一定影响。
图11不同提取方法蛋白质乳化性及乳化稳定性
3 结论
本研究以菜籽饼和亚麻籽饼为原料,选择碱溶酸沉法、乙醇浸提法、酶解法和盐析法四种方法分离提取菜籽蛋白和亚麻籽蛋白,对蛋白样品的品质特性对比研究,研究表明,不同制备方法对菜籽蛋白和亚麻籽蛋白的等电点不产生影响,而对于结构特性和加工功能特性具有较大影响,其中通过盐析法提取的两种蛋白中α-螺旋和β-折叠之和分别为42.94%和46.43%,相较于其他三种方法提取的蛋白具有更稳定的二级结构。不同提取方法所得两种蛋白的荧光强度和紫外吸收能力具有差异,由于不同处理导致蛋白质构象发生改变,这与微观结构观察结果一致。盐析法提取的两种蛋白溶解度分别为68.19%和64.90%,酶解法为66.72%和55.23%,说明盐析法和酶解法提出的蛋白其较高的溶解性可应用于饮品的生产加工。而盐析法提取的两种蛋白表现除更好的功能特性,持水性(58.00%和40.33%)、持油性(57.00%和35.83%)、起泡性(91.67%和89.29%)、乳化性(71.38%和32.75%)和乳化稳定性(32.75%和65.37%)都优于其他三种方法,在蛋糕、面包、冰激凌等食品加工中有较好的应用前景。因此,说明盐析法是一种适合工业化生产的、优质的菜籽蛋白和亚麻籽蛋白的制备方法。
参考文献
[1] 易起达. 酶解制备菜籽肽及其抗氧化作用研究[D]. 南京: 南京财经大学, 2013.
[2] 杨雪艳, 聂开立, 林风, 等. 亚麻籽功能成分的综合提取工艺研究[J]. 中国油脂, 2017, 42(1): 116-120+124.
[3] 刘胜. 高温菜籽粕蛋白质的提取及其酶法改性[D]. 南京: 南京财经大学, 2010.
[4] 马德坤. 亚麻籽蛋白提取表征及负载脂溶性小分子研究[D]. 天津: 天津科技大学, 2022.
[5] 孙乾, 张爱琴, 薛雨菲, 等. 化学改性对核桃谷蛋白结构表征及功能特性的影响[J]. 食品科学, 2019, 40(20): 87-93.
[6] 徐江波, 肖江, 陈元涛, 等. 响应曲面法优化亚麻籽蛋白提取工艺[J]. 食品研究与开发, 2014, 35(20): 36-41.
[7] 张丽霞, 张振山, 史鹏飞, 等. 乙醇浸提法制备亚麻籽浓缩蛋白工艺研究[J]. 中国油脂, 2019, 44(10): 51-54.
[8] 童晶晶, 张晓元, 赖富饶 等. 盐水浸提法提取张溪香芋蛋白的工艺优化[J]. 食品工业, 2016, 37(7): 1-5.
[9] 翟晓娜, 汪涛, 梁亮, 等. 菜籽粕蛋白的碱溶酸沉工艺优化及其活性研究[J]. 食品工业科技, 2022, 43(9): 164-171.
[10] KARACAA C, LOW N, NICKERSON M. Emulsifying properties of canola and flaxseed protein isolates produced by isoelectric precipitation and salt extraction[J]. Food Research International, 2011, 44(9).
[11] MINA T, PATRICK S, ALAN C, et al. Effect of extraction method on functional properties of flaxseed protein concentrates[J]. Food Chemistry, 2017, 215: 417-424.
[12] 杨洁茹, 刘海波, 李晴, 等. 油茶饼粕中多肽的分离纯化及抗氧化研究[J]. 粮食与食品工业, 2022, 29(5): 4-9.
[13] 施树. 胡麻分离蛋白及其性质的研究[D]. 重庆:西南大学, 2008.
[14] 吴兴雨, 孙凯杨, 姚玥, 等. 两种方法提取的亚麻籽蛋白持水性、持油性、溶解性和氨基酸组成比较[J]. 中国油脂, 2021, 46(4): 43-46+51.
[15] 刘英杰, 陈红宇, 李子微, 等. 花青素共价交联大豆蛋白对其表面疏水性及功能性的影响[J]. 食品工业科技, 2019, 40(7): 5-10.
[16] 邓芝串, 张晖, 张超, 等. 籽瓜种子蛋白质的持水及持油性研究[J]. 中国粮油学报, 2015, 30(9): 49-54.
[17] WANG H, JOHNSON L A, Wang T, et al. Preparation of soy protein concentrate and isolate from extruded-expelled soybean meals[J]. Journal of the American Oil Chemists Society, 2004, 81(7): 713-717.
[18] SADAT A, JOYE I J. Peak Fitting Applied to Fourier Transform Infrared and Raman Spectroscopic Analysis of Proteins[J]. Applied Sciences, 2020, 10(17).
[19] 田然, 冯俊然, 隋晓楠, 等. 高强度超声处理对大豆7S和11S球蛋白结构和理化性质的影响[J]. 食品工业科技, 2022, 43(5): 87-97.
[20] LI L, MURIEL S. Study of the acid and thermal stability of β-lactoglobulin-lig and complexes using fluorescence quenching[J]. Food Chemistry, 2012, 132(4): 2023-2029.
[21] CHEN L, ETTELAIE R, AKHTAR M, et al. Improved enzymatic accessibility of peanut protein isolate pre-treated using thermosonication[J]. Food Hydrocolloids, 2019, 93(21): 308-316.
[22] XING L, ZZHAO F M, CAO Y F, et al. Process of ultrasonic extraction of linseed oil and its effect on the microstructure of Linseed[J]. Journal of the China Cereals and Oils Society, 2015, 30(12): 80-86.
[23] NADATHUR S R, WANASUNDARA J P D, SCANKIN L. Sustainable protein sources[M]. London: Academic Press, 2016: 285-304.
[24] 张英蕾, 姚鑫淼, 卢淑雯, 等. 碱溶酸沉法提取黑豆蛋白工艺优化[J]. 中国食品添加剂, 2019, 30(1): 60-68.
[25] 孙雪, 赵晓燕, 朱运平, 等. 反胶束对植物蛋白的结构、功能性和应用的影响研究进展[J]. 中国粮油学报, 2020, 35(1): 196-202.
[26] TIAN Y, TAHA A ZHANG P, et al. Effects of protein concentration, pH, and NaCl concentration on the physicochemical, interfacial, and emulsifying properties of β-conglycinin[J]. Food Hydrocolloids, 2021, 118.
[27] 冯芳, 刘文豪, 陈志刚, 等. 大豆7S、11S 蛋白的结构与热致凝胶特性的分析[J]. 食品科学, 2020, 41(2): 58-64.
文章摘自:冶梓芩,王进英,马桂兰等. 不同提取方法对菜籽和亚麻籽饼蛋白品质特性影响研究 [J/OL]. 中国油脂, 1-13[2024-03-04]. https://doi.org/10.19902/j.cnki.zgyz.1003-7969.230658.