摘 要:一种具有抗血栓活性的汉麻仁多肽序列的筛选方法,属于功能食品领域。所述方法为:以汉麻仁蛋白为原料,凝血酶抑制率为指标,筛选最优酶及酶解最佳工艺条件,得到凝血酶抑制活性最高的酶解液;将酶解液逐级分离纯化,得到凝血酶抑制活性最高的分子量段进行多肽序列鉴定;获得的序列通过与凝血酶进行柔性配体对接,计算得到多肽序列与凝血酶底物结合结合分子对接打分、多肽序列鉴定打分、丰度及氨基酸数量进行筛选,选择几个多肽序列进行凝血酶抑制率的试验验证,验证后凝血酶抑制活性最高的多肽序列进行生物固相合成,进行斑马鱼体内的抗血栓活性。本发明中体内验证采用的是斑马鱼试验,周期更短、观察更直观、用样量更少、可行性更高。
权利要求书
1.一种具有抗血栓活性的汉麻仁多肽序列的筛选方法,其特征在于:所述方法为:
步骤一:酶解:以汉麻仁蛋白为原料,以凝血酶抑制率为指标,筛选最优酶、优化酶解最佳工艺条件,得到凝血酶抑制活性最高的酶解液;
步骤二:鉴定酶解肽序列:将步骤一中的酶解液逐级分离纯化,得到凝血酶抑制活性最高的分子量段进行多肽序列鉴定;
步骤三:分子对接:获得的序列通过与凝血酶进行柔性配体对接,进行计算,得到多肽序列与凝血酶底物结合打分;
步骤四:选定几种进行体外验证:结合分子对接打分、多肽序列鉴定打分、丰度及氨基酸数量进行筛选,选择8个多肽序列进行了生物合成,采用凝血酶抑制率的试验进行验证,
检测这8个序列是否具有凝血酶抑制活性,若有,则进行步骤五,若没有,则结合打分高的重新选择多肽序列进行生物合成;
步骤五:体内验证:选择验证后凝血酶抑制活性最高的多肽序列进行生物固相合成,进行斑马鱼体内抗血栓试验,验证其在体内是否具有抗血栓活性,若有,则成功筛选得到具有抗血栓活性的汉麻仁多肽序列,若没有,则返回步骤四,结合打分高的重新选择多肽序列进行生物合成。
2.根据权利要求1所述的一种具有抗血栓活性的汉麻仁多肽序列的筛选方法,其特征在于:所述方法为:
步骤一:以汉麻仁蛋白为原料,以优化的酶解工艺进行生物转化获得混合汉麻仁抗血栓肽;
步骤二:通过动态错流浓缩膜过滤技术纯化得到了分子量在3000Da以下的汉麻仁抗血栓肽,并进行肽段鉴定,获得了1749个多肽序列;
步骤三:采用分子对接生物信息学手段预测筛选出了具有高抗血栓活性的汉麻肽序列103个;
步骤四:结合分子对接打分、多肽序列鉴定打分、丰度及氨基酸数量进行筛选,从103个汉麻肽序列中优选了8个进行生物合成,并通过体外凝血酶抑制活性从这8个中筛选出最优的;(筛选标准:根据①分子对接结合能打分情况(绝对值高于100);②液质连用多肽序列鉴定打分情况(高于100);③液质连用多肽序列鉴定的丰度(大于1*107));
步骤五:体内验证:选择验证后凝血酶抑制活性最高的多肽序列进行生物固相合成,进行斑马鱼体内抗血栓试验,验证其在体内的抗血栓活性。
3.根据权利要求2所述的一种具有抗血栓活性的汉麻仁多肽序列的筛选方法,其特征在于:步骤一中,酶解工艺条件为温度37?50℃,料液比1:16?40,酶添加量1%?7%,pH7.0?8.5。
4.根据权利要求2所述的一种具有抗血栓活性的汉麻仁多肽序列的筛选方法,其特征在于:步骤一中,酶解工艺条件为温度40℃,料液比1:25,酶添加量5.68%,pH8.0。
5.一种权利要求1~4任一项筛选得到的汉麻仁多肽序列在制备抗血栓药物中的应用。
技术领域
本发明属于功能食品领域,具体涉及一种具有抗血栓活性的汉麻仁多肽序列的筛选方法。
背景技术
大麻血栓的形成在各种心血管疾病的发病机理中起关键作用,血栓类疾病严重威胁着人类的健康[1]。据统计,血栓导致的死亡已达全球总死亡人数的51%,远高于肿瘤及其他疾病的死亡率,是目前国家重点监控防治的一类疾病。
特别是在新冠病毒出现以来,起初被认为主要引起肺炎和急性呼吸窘迫综合征(Acute respiratory distress syndrome,ARDS)等呼吸道相关临床特征的COVID?19[2],被越来越多的研究发现与静脉、动脉和微血管血栓形成的血栓前状态密切相关。尸检研究表明,静脉血栓栓塞可能是导致COVID?19重症患者死亡的主要原因[3]。因此,血栓的预防和治疗已成为当今学界一大热点问题。由于目前临床上传统的抗血小板药物和抗凝药物仍存在出血事件、药效不够、选择性差等弊端,因而高效且副作用小的抗血栓药物及其预防和治疗作用机制成为学者们研究的重点。目前常采用合成方法或从生物中提取两种手段获得抗血栓肽,合成方法得到的抗血栓肽成本高,不利于临床应用,生物提取的抗血栓肽源多为毒蛇、蜈蚣、水蛭等有安全性问题的生物,获得的抗血栓肽易携带本身具有的副作用。而在大健康、治未病时代来临之际,采用食源性原料获取抗血栓活性肽,无毒害作用,安全性高,在人的肠胃内很快被消化吸收,进而在人体的抗血栓系统中发挥作用。
汉麻又称火麻,作为高生态性且具有特殊作用的经济作物,于2002年被列入药食同源目录,成为药食两用的功能性食品原料。我国对汉麻仁的研究较早,李时珍在《本草纲目》中对汉麻仁的医用价值有记载,称其能“补中益气,久服肥健不老”,“去风痹皮顽,令人心欢,利大肠、风热结燥”,“破积血,复血脉,去乳妇产后余疾,取汁煮粥食,止呃逆”等。现代医学研究表明,汉麻仁有较好的降血压、利尿、镇痛、抗炎、预防血栓形成的作用,长期食用,对慢性神经炎、瘫痪、便秘、高血压、高血脂、溃疡以及妇科疾病具有很好的辅助疗效[4]。丛涛[5]等研究了汉麻仁对生长期大鼠营养生理功能的影响,发现服用汉麻蛋白质的大鼠血清总蛋白显著降低,但血清白蛋白占比最高,达78.2%,血清白蛋白具有抑制血小板聚集、抗凝血以及提高免疫力的生理功能。通过本课题组多年对汉麻仁蛋白提取物的细胞学及小鼠试验研究中也发现汉麻仁含有抗肝癌、抗炎、抗菌以及促重金属代谢的多种肽[6,7]。传统的食源性生物活性肽的主要筛选鉴定方法为:选定目标蛋白、蛋白水解、分离或纯化水解产物或者单个肽段、活性测定及验证肽的活性。在此过程中,蛋白分离纯化将会耗费大量的样品和纯化时间,且结果不能得到保障;每次纯化的数量有限,分离之后收集的样品经各种浓缩干燥等过程,会造成大量的损失。同时传统的食药体内试验常采用小鼠、大鼠、豚鼠等作为模型生物。虽然稳定性好,但是试验周期长、活性物质消耗量大,试验成本非常高。
[1] 马广大.心血管疾病急诊患者的临床特点分析及临床治疗对策[J].世界最新医学信息文摘,2019,19(56):46?47.
[2] Ahmed S ,Zimba O ,Gasparyan A Y .Thrombosis in Coronavirus disease 2019(COVID?19)through the prism of Virchow 's triad[J] .Clin Rheumatol ,2020 ,39(9):2529?2543.
[3] Zhou P ,Yang X L ,Wang X G ,et al .A pneumonia outbreak associated with a new coronavirus of probable bat origin[J] .Nature ,2020 ,579(7798):270?273.
[4] 宋淑敏,刘宇峰,董艳等.汉麻籽的营养价值及开发利用[J].农产品加工,2016,(9):54?55.
[5] 丛涛,江雪媛,赵霖等.火麻仁蛋白质粉对生长期大鼠营养生理功能的影响研究[J].中国食品学报,2011,11(02):60?69.
[6] 魏连会,董艳,石杰等.汉麻籽粕酶解物中抗肝癌Hep3B细胞活性肽的分离与鉴定[J].中国粮油学报,2022,37(03):74?78.
[7] 魏连会,宋淑敏,董艳等.汉麻籽多肽的氨基酸营养组成与体外结合胆酸盐能力的研究[J].中国粮油学报,2020,35(01):62?66.
本发明的目的是提供一种具有抗血栓活性的汉麻仁多肽序列的筛选方法,同时为筛选的汉麻仁蛋白提供一种新的应用方式,提供一种血栓类疾病预防和治疗的一种安全的途径。
本发明以汉麻仁蛋白为原料,以优化的酶解工艺进行生物转化获得混合汉麻仁抗血栓肽;通过动态错流浓缩膜过滤技术纯化得到了分子量在3000Da以下的汉麻仁抗血栓肽,并进行肽段鉴定,获得了1749个多肽序列;采用分子对接等生物信息学手段预测筛选出了具有高抗血栓活性的汉麻肽(结合能打分绝对值>100分)序列103个,优选了8个进行生物合成,并验证其体外凝血酶抑制活性;选择凝血酶抑制活性最好的一个多肽序列(DERQREIEQERR)进行了斑马鱼血栓模型试验,验证了其体内抗血栓活性。
为实现上述目的,本发明采取的技术方案如下:
一种具有抗血栓活性的汉麻仁多肽序列的筛选方法,所述方法为:
步骤一:酶解:以汉麻仁蛋白为原料,以凝血酶抑制率为指标,筛选最优酶、优化酶解最佳工艺条件,得到凝血酶抑制活性最高的酶解液;
步骤二:鉴定酶解肽序列:将步骤一中的酶解液逐级分离纯化,得到凝血酶抑制活性最高的分子量段进行多肽序列鉴定;
步骤三:分子对接:获得的序列通过与凝血酶进行柔性配体对接,进行计算,得到多肽序列与凝血酶底物结合打分;
步骤四:选定几种进行体外验证:结合分子对接打分、多肽序列鉴定打分、丰度及氨基酸数量进行筛选,选择8个多肽序列进行了生物合成,采用凝血酶抑制率的试验进行验证,检测这8个序列是否具有凝血酶抑制活性,若有,则进行步骤五,若没有,则结合打分高的重新选择多肽序列进行生物合成;
步骤五:体内验证:选择验证后凝血酶抑制活性最高的多肽序列进行生物固相合成,进行斑马鱼体内抗血栓试验,验证其在体内是否具有抗血栓活性,若有,则成功筛选得到具有抗血栓活性的汉麻仁多肽序列,若没有,则返回步骤四,结合打分高的重新选择多肽序列进行生物合成。
进一步地,所述方法为:
步骤一:以汉麻仁蛋白为原料,以优化的酶解工艺进行生物转化获得混合汉麻仁抗血栓肽;
步骤二:通过动态错流浓缩膜过滤技术纯化得到了分子量在3000Da以下的汉麻仁抗血栓肽,并进行肽段鉴定,获得了1749个多肽序列;
步骤三:采用分子对接生物信息学手段预测筛选出了具有高抗血栓活性的汉麻肽序列103个;
步骤四:结合分子对接打分、多肽序列鉴定打分、丰度及氨基酸数量进行筛选,从103个汉麻肽序列中优选了8个进行生物合成,并通过体外凝血酶抑制活性从这8个中筛选出最优的;(筛选标准:根据①分子对接结合能打分情况(绝对值高于100);②液质连用多肽序列鉴定打分情况(高于100);③液质连用多肽序列鉴定的丰度(大于1*107));
步骤五:体内验证:选择验证后凝血酶抑制活性最高的多肽序列进行生物固相合成,进行斑马鱼体内抗血栓试验,验证其在体内的抗血栓活性。
进一步地,步骤一中,酶解工艺条件为温度37?50℃,料液比1:16?40,酶添加量1%?7%,pH7.0?8.5。
进一步地,步骤一中,酶解工艺条件为温度40℃,料液比1:25,酶添加量5.68%,pH8.0。
一种上述筛选方法得到的汉麻仁多肽序列在制备抗血栓药物中的应用。
本发明相对于现有技术的有益效果为:本发明采用药食同源的汉麻仁获取抗血栓活性肽,无毒害作用,安全性高,在人的肠胃内很快被消化吸收,进而在人体的抗血栓系统中发挥作用。本发明中体内验证采用的是斑马鱼试验,它为抗血栓活性食药的研究提供了周期更短、观察更直观、用样量更少、可行性更高的体内研究评价手段。
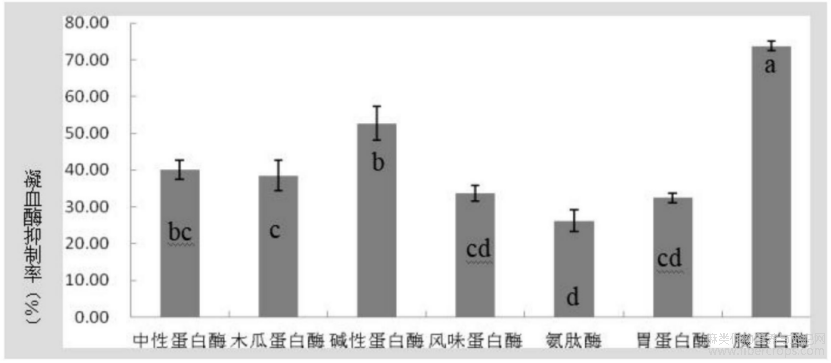
图1为不同酶解液凝血酶抑制率(P<0.05)对比图;
图1
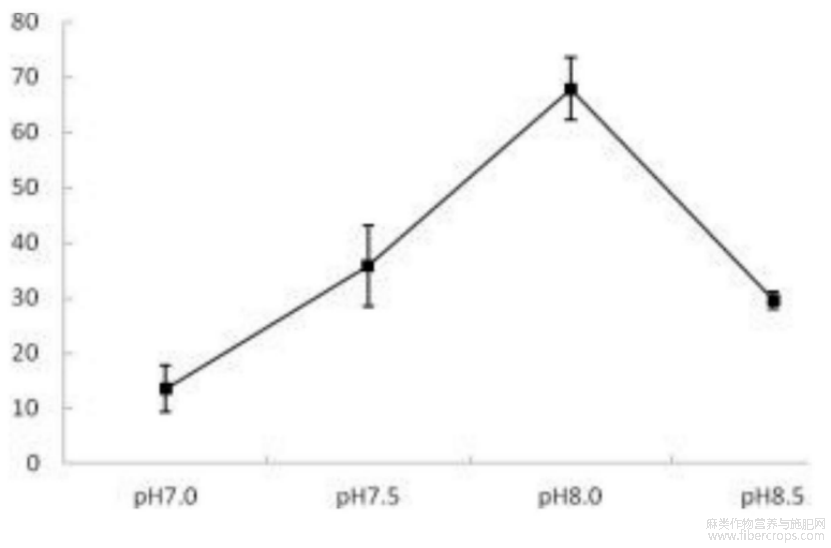
图2为不同pH对汉麻仁抗血栓肽凝血酶抑制活性的影响图;
图2
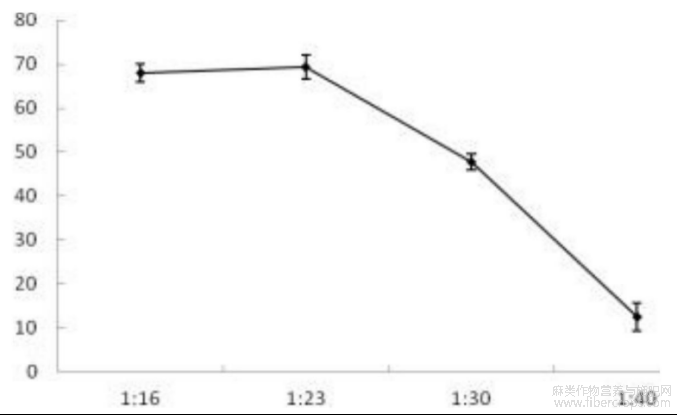
图3为不同料液比对汉麻仁抗血栓肽凝血酶抑制活性的影响图;
图3
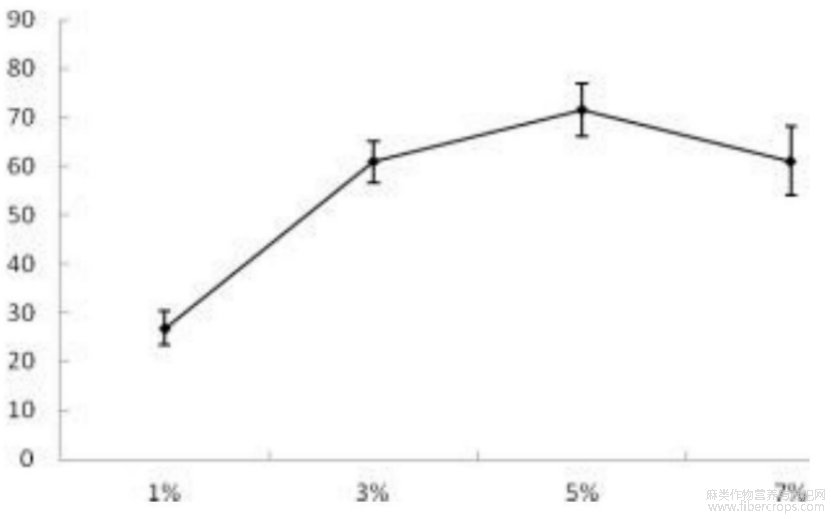
图4为不同加酶量对汉麻仁抗血栓肽凝血酶抑制活性的影响图;
图4
图5为不同酶解温度对汉麻仁抗血栓肽凝血酶抑制活性的影响图;
图5
图6为LC?MSMS检测结果图;
图6
图7为2BVR的分子对接袋示意图;
图7
图8为汉麻仁多肽DERQREIEQERR与凝血酶复合物结构图;
图8
图9为斑马鱼心脏红细胞染色强度示例图;
图9
图10为斑马鱼心脏红细胞染色强度正常对照组示例图;
图10
图11为斑马鱼心脏红细胞染色强度模型对照组示例图;
图11
图12为斑马鱼心脏红细胞染色强度阿司匹林50μg/mL示例图;
图12
图13为斑马鱼心脏红细胞染色强度汉麻仁抗血栓肽31.2μg/mL示例图;
图13
图14为斑马鱼心脏红细胞染色强度汉麻仁抗血栓肽62.5μg/mL示例图;
图14
图15为斑马鱼心脏红细胞染色强度汉麻仁抗血栓肽125μg/mL示例图;
图15
图16为汉麻仁抗血栓肽处理后斑马鱼心脏红细胞染色强度图;
图16
图17为汉麻仁抗血栓肽处理后斑马鱼血流速度图;
图17
图18为斑马鱼节间血管直径分析区域示例图;
图18
图19为斑马鱼节间血管直径分析区域正常对照组示例图;
图19
图20为斑马鱼节间血管直径分析区域模型对照组示例图;
图20
图21为斑马鱼节间血管直径分析区域阿司匹林50.0μg/mL示例图;
图21
图22为斑马鱼节间血管直径分析区域汉麻仁抗血栓肽31.2μg/mL示例图;
图22
图23为斑马鱼节间血管直径分析区域阿司匹林62.5μg/mL示例图;
图23
图24为斑马鱼节间血管直径分析区域汉麻仁抗血栓肽125μg/mL示例图;
图24
图25为汉麻仁抗血栓肽处理后斑马鱼节间血管直径图;
图25
图26为vegfr1基因相对表达量图;
图26
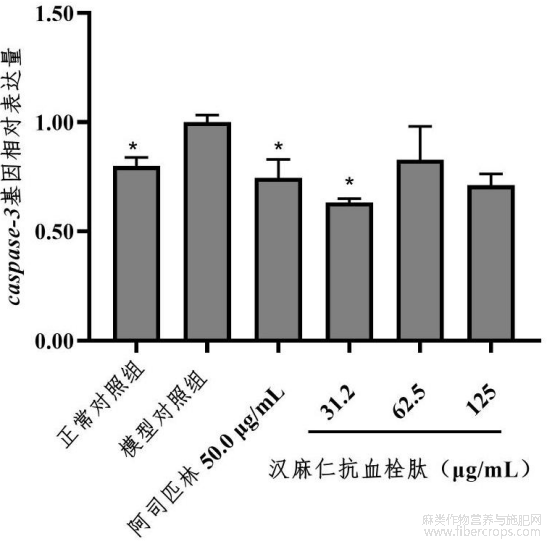
图27为caspase?3基因相对表达量图。
图27
具体实施方式
下面结合附图和实施例对本发明的技术方案进行进一步的说明,但并不局限于此,凡是对本发明技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,均应涵盖在本发明的保护范围中。
实施例1:
一种具有抗血栓活性的汉麻仁多肽序列的制备和发现过程:
1.多酶种筛选试验:
材料与试剂:汉麻蛋白粉:本实验室CO2超临界萃取除油粉碎后获得,蛋白质含量69%;胰蛋白酶(猪源、EC3.4、酶活力1:250)、胃蛋白酶(猪源、EC3.4、酶活力1:3000)、中性蛋白酶(EC3.4、酶活力50U/mg)、凝血酶(EC3.4、酶活力2000U/mg)、纤维蛋白原(牛血浆):上海麦克林生化科技有限公司;木瓜蛋白酶、风味蛋白酶、氨肽酶、碱性蛋白酶:无锡雪酶酶制剂科技有限公司;盐酸,氢氧化钠,三羧甲基氨基甲烷(Tris)均为分析纯。
方法:称取7份汉麻仁蛋白粉,每份5g,分别加入7种蛋白酶0.25g、水80mL,pH调至最适,温度最适,酶解5h后90℃灭酶10分钟,5000rpm离心15min,取上清液用于凝血酶抑制率的检测。使用酶标仪比色法测定凝血酶抑制率。以Tris?HCl缓冲液(0.05mol/L,pH=7.4)配置纤维蛋白原溶液(1.5mg/mL)和凝血酶溶液(10U/mL)。酶标板上加入140μL纤维蛋白原溶液和40μL样品溶液,混匀后于405nm波长处读数(ASB),加入20μL凝血酶溶液后于37℃恒温反应20min后读数(AS)。空白采用40μLTris?HCl缓冲液,其他操作同样品管,测得吸光值读数(ACB)和(AC)。凝血酶抑制计算公式如下:
凝血酶抑制率(%)=![]()
结果:由图1可见,试验中选择的七种酶在理论最优酶解条件下对汉麻仁进行水解后,各酶解液均对凝血酶具有一定的抑制作用,其中胰蛋白酶酶解液对凝血酶的抑制作用显著高于其他水解酶,达到73.65%,因此选择胰蛋白酶作为最优酶,进行下一步工艺优化试验。
2.汉麻仁抗血栓混合肽制备工艺优化试验:
材料与试剂:汉麻蛋白粉:本实验室CO2超临界萃取除油粉碎后获得,蛋白质含量69%;胰蛋白酶(猪源、EC3.4、酶活力1:250):上海麦克林生化科技有限公司;盐酸,氢氧化钠,三羧甲基氨基甲烷(Tris)均为分析纯。
方法:单因素试验:采用胰蛋白酶对汉麻仁蛋白进行水解。固定汉麻仁蛋白添加量为1.5g,酶解时间为5小时,以凝血酶抑制率为相应指标,分别探讨料液比、温度、酶添加量(以蛋白浓度为底物)和pH对汉麻仁抗血栓肽制备的影响,从而确定响应面试验中各因素的水平。如表1。
表1 单因素试验
|
A 温度(℃) |
B 料液比 |
C 酶添加量(%) |
D pH |
|
37 |
1:16 |
1 |
7.0 |
|
41 |
1:23 |
3 |
7.5 |
|
45 |
1:30 |
5 |
8.0 |
|
50 |
1:40 |
7 |
8.5 |
响应面优化设计:根据单因素试验结果,选取温度、料液比、酶添加量和pH试验影响因素,分别以A、B、C、D代表,以凝血酶抑制率为响应值,设计四因素三水平(表2)的响应面分析法。利用Design Expert.V8.0.6软件进行响应面优化。
表2 响应面因素水平表
|
试验因素 |
试验水平 |
||
|
-1 |
0 |
1 |
|
|
A 温度(℃) |
37 |
41 |
45 |
|
B 料液比 |
1:16 |
1:23 |
1:30 |
|
C 酶添加量(%) |
3 |
5 |
7 |
|
D pH |
7.5 |
8.0 |
8.5 |
结果:单因素试验结果:图2~5可见,随着pH的升高,汉麻仁抗血栓肽的凝血酶抑制活性逐渐升高,pH8.0时达到67.86%,但是当pH为8.5时凝血酶活性又有所下降,这可能是由于pH值过高导致汉麻仁蛋白或胰蛋白酶部分变性引起的酶解效率减弱,使得酶解获得的抗血栓肽减少。
较高的料液比有利于汉麻仁抗血栓肽发挥凝血酶抑制活性,特别是在料液比为1:16和1:23时,汉麻仁抗血栓肽的凝血酶抑制率均达到70%左右,过低的料液比降低了酶解液的凝血酶抑制活性,这可能是由于稀释了体系中汉麻仁抗血栓肽的浓度导致的。
当加酶量为1%时抑制率较低,只有26%,这是由于反应体系中胰蛋白酶浓度较低,从而导致水解度较低,生成的汉麻仁抗血栓活性片段也较低。凝血酶抑制率在加酶量为5%时达到最大值71.55%,随后随着加酶量增加反而呈下降趋势,分析原因可能是由于加酶量过高导致了底物过度酶解,减少了体系中汉麻仁抗血栓活性片段的浓度。
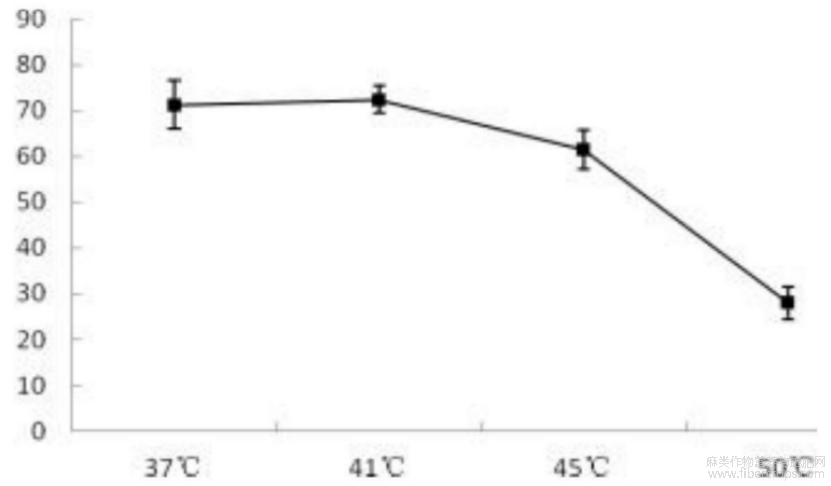
随着酶解温度的升高,凝血酶抑制率从平稳逐渐降低,在41℃时达到最大值,随后开始下降,在50℃时将至27.98%,这可能是因为过高的温度导致胰蛋白酶活性下降,使汉麻仁抗血栓肽的浓度降低。
响应面结果与分析:
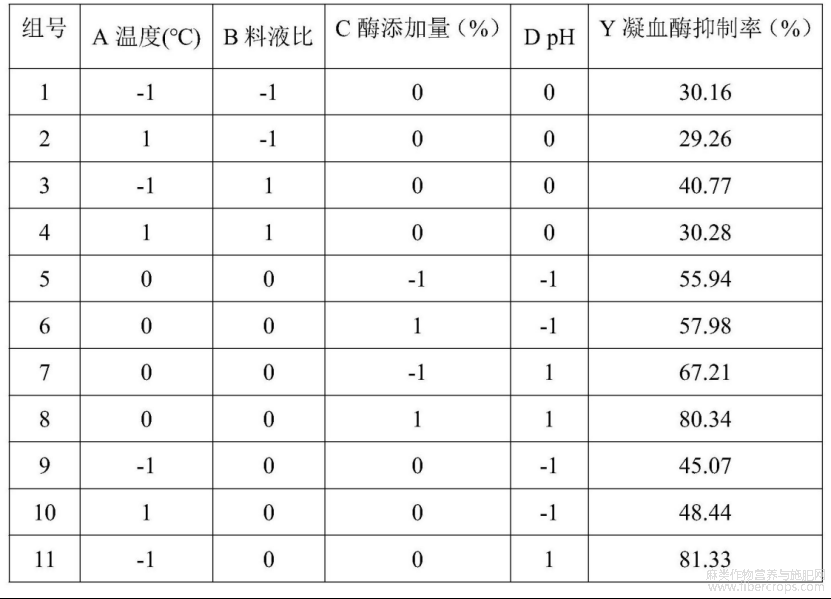
利用Design?Expert.V8.0.6软件对表中汉麻仁抗血栓活性肽的凝血酶抑制率数据结果进行多元回归拟合,得到各因素与响应值凝血酶抑制率(Y)回归模型拟合公式为:Y=76.88?4.42A+4.77B+2.99C+8.13D?8.89AD+11.03BD+2.77CD?16.85A2?27.50B2?8.54C2?3.06D2。
表3 响应面试验设计结果
表4为回归模型方差的分析结果,F=74.46,回归模型p<0.01,极显著。失拟项p=0.0020<0.01,极显著。模型回归系数R2=0.9797,这说明所建模型拟合效果较好,可以解释97.97%的响应值变化。校正后的模型系数R2Adj=0.9665,说明了模型的准确性较好。因此该方法可用于分析和预测汉麻仁抗血栓活性肽的提取工艺。从表中模型系数的分析可知,四个因素p值均小于0.01,达到极显著水平,说明对汉麻仁抗血栓活性肽的提取影响明显;在交互项中,AD和BD的p值均小于0.01,表明两两因素之间影响极显著(参见图6)。根据F值大小得出四个因素对汉麻仁抗血栓活性肽提取工艺的影响顺序:pH>料液比>温度>酶添加量。汉麻仁抗血栓活性肽的最优工艺参数为:温度40℃,料液比1:25,酶添加量5.68%,pH8.0。该条件下预测的凝血酶抑制率最大,为87.83%。
表4 响应面回归模型方差分析结果
注:*表示显著(p<0.05),**表示极显著(p<0.01)
按照模型得出的最佳工艺条件进行了三次验证试验,最终所得凝血酶抑制率平均值为84 .70%,与回归模型预测值相比,特异性活力相对误差为3 .57%,结果表明,本方法具有较好的预测性和准确性,能够预测和分析汉麻仁抗血栓活性肽的最佳提取工艺。
3.汉麻仁抗血栓肽的纯化和序列检测、鉴定:
材料与试剂:汉麻蛋白粉:本实验室CO2超临界萃取除油粉碎后获得,蛋白质含量69%;胰蛋白酶(猪源、EC3 .4、酶活力1:250):上海麦克林生化科技有限公司;盐酸,氢氧化钠,三羧甲基氨基甲烷(Tris)均为分析纯。
方法:使用3000Da和5000Da分子截留量的超滤膜进行超滤纯化,滤液进行冻干、收集后根据浓度需要配置成0 .005g/mL、0 .01g/mL、0 .02g/mL的溶液进行凝血酶抑制率的检测。同时采用Maldi?tof和LC?MSMS方法进行分子量分布检测和多肽序列鉴定。
结果:本研究采用超滤膜技术将获得的混合汉麻仁抗血栓粗肽进行了3000Da以下和5000Da以下两种分子量级的分级分离,并进行了凝血酶抑制率的检测,结果如表5。通过超滤、冻干、定量取样检测,可见分子量在3000以下的汉麻仁抗血栓肽在浓度为0 .01g/mL有着更强的凝血酶抑制率,可以达到99%。
表5 不同分子量、不同浓度汉麻仁抗血栓肽凝血酶抑制率检测结果
|
浓度(g/mL) |
3000Da以下 |
5000Da以下 |
|
0.005 |
83.55 |
48.39 |
|
0.01 |
99.38 |
62.44 |
|
0.02 |
88.56 |
59.64 |
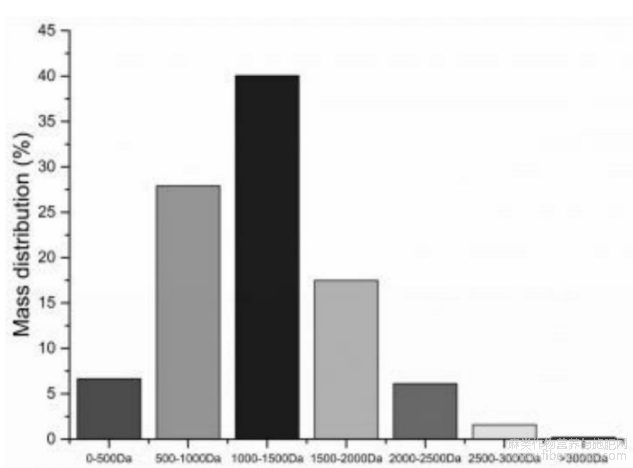
采用LC?MSMS方法进行了3000Da以下多肽的鉴定,结果得到多肽序列1741个,氨基酸数量均在25个以下。分布结果统计如图6所示,发现40%的多肽均在1000~1500Da之间,数量为677个,多数为13个氨基酸以下的多肽。500~1000Da的多肽含量为27 .5%,数量为302个。由此可见,酶解后汉麻仁蛋白分解成了更多小分子的多肽,这些小分子多肽的抗血栓活性更高。结合表5的结果看,酶解后仍有小部分大分子的汉麻仁多肽,会降低汉麻仁多肽的抗血栓活性。
4.汉麻仁抗血栓肽序列与凝血酶分子对接计算结果及体外验证:
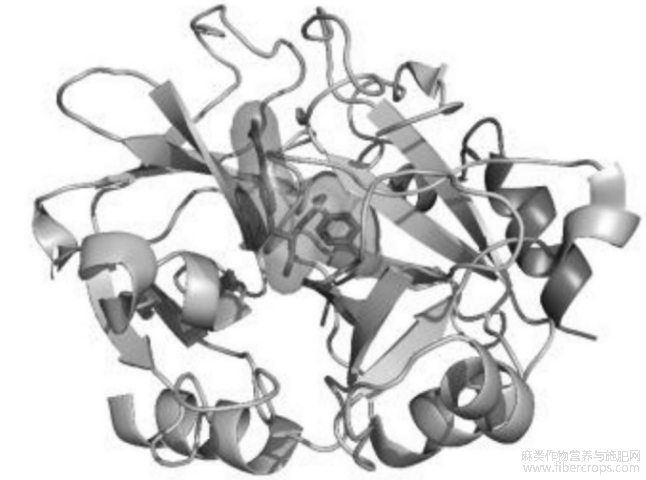
凝血酶的结构从RCSBPDB数据库下载,PDBID为2BVR。利用RDKit(https://rdkit.org)构建1079个肽段的结构。选取1079个多肽作为虚拟库。在对接过程中,利用UCSFChimera2将受体和多肽转化为MOL2格式用于之后的对接。对接时使用2BVR的天然配体(4CP)结合位点坐标生成盒子,采用网格参数文件计算网格。使用默认参数进行柔性配体对接,并为每个配体生成一个构象。DOCK6是基于非键相互作用进行打分。对接后,利用obabel得到配体与受体的PDB复合物结构。2BVR的分子对接袋如图7所示。
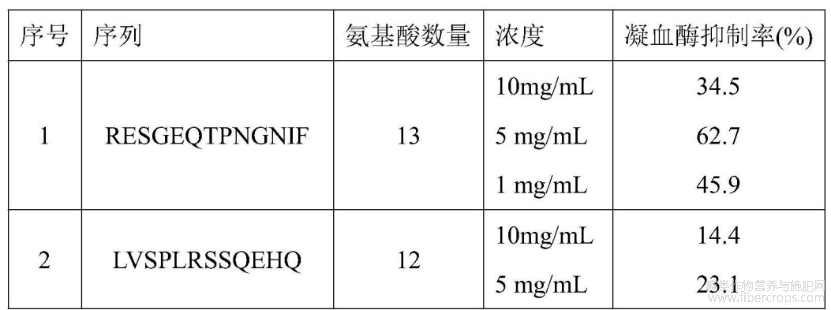
计算结果发现结合能绝对值在100分以上的多肽为90个,氨基酸数量分布于11?13个之间。综合考虑肽段鉴定打分结果、虚筛打分结果及肽段丰度结果,选择8个多肽序列进行了生物固相合成,并通过凝血酶抑制率试验进行了验证,结果如表6:
表6 合成多肽凝血酶抑制活性结果
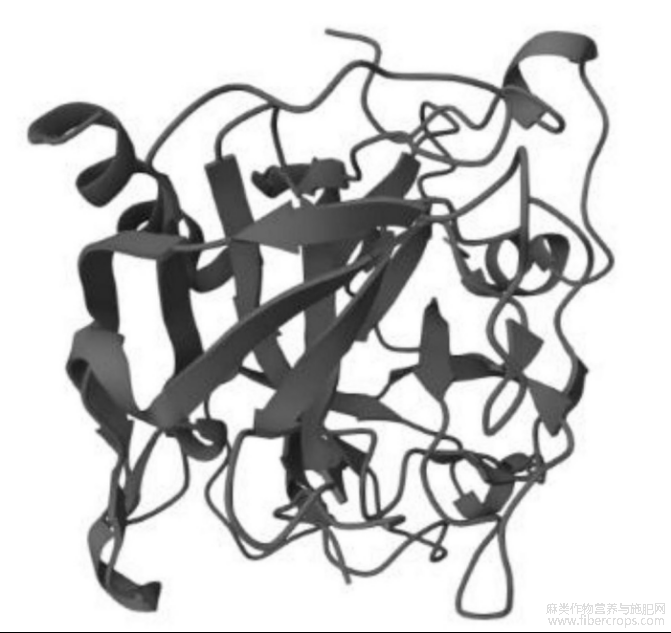
汉麻仁十二肽序列DERQREIEQERR(Asp?Glu?Arg?Gln?Arg?Glu?Ile?Glu?Gln?Glu?Arg?Arg与凝血酶复合物结构如图8,最终选择该序列进行固相合成并进行斑马鱼体内抗血栓效果验证。
血管内皮损伤改善功效评价:
1.检测材料
1.1.样品配制信息
汉麻仁抗血栓肽,用标准稀释水配制成20.0mg/mL母液,现用现配;
阳性对照:阿司匹林肠溶片(以下简称阿司匹林),批号为BJ54728,拜耳医药保健有限公司,阴凉干燥避光储存。用DMSO配制成50.0mg/mL母液,?20℃储存。
1.2.实验动物
斑马鱼均饲养于28℃的养鱼用水中(水质:每1L反渗透水中加入200mg速溶海盐,电导率为450~550μS/cm;pH为6.5~8.5;硬度为50~100mg/LCaCO3),由本公司养鱼中心繁殖提供,实验动物使用许可证号为:SYXK(浙)2022?0004,饲养管理符合国际AAALAC认证(认证编号:001458)的要求。
黑色素等位基因突变型Albino品系斑马鱼,以自然成对交配繁殖方式进行。年龄为受精后5天(5dpf)的斑马鱼用于汉麻仁抗血栓肽血管内皮损伤改善功效最大检测浓度(MTC)测定及其功效评价。
野生型AB品系斑马鱼,以自然成对交配繁殖方式进行。年龄为5dpf的斑马鱼用于汉麻仁抗血栓肽血管内皮损伤性血栓血流动力学改善功效评价。
转基因血管绿色荧光斑马鱼(fli?1品系),以自然成对交配繁殖方式进行。年龄为5dpf的斑马鱼用于汉麻仁抗血栓肽血管内皮损伤性血栓节间血管直径改善功效评价。
野生型AB品系斑马鱼,以自然成对交配繁殖方式进行。年龄为5dpf的斑马鱼用于汉麻仁抗血栓肽血管内皮损伤性血栓改善功效机制研究。
1.3.仪器、耗材与试剂
解剖显微镜(SZX7,OLYMPUS,Japan);CCD相机(VertA1,上海土森视觉科技有限公司,China);心跳血流分析系统(ZebraBlood3.4,View Point Life Sciences,France);精密电子天平(CP214,OHAUS,USA);6孔板(Nest Biotech,China);电动聚焦连续变倍荧光显微镜(AZ100,Nikon,Japan);高速冷冻离心机(Heraeus Fresco17,Thermo Fisher,Germany);
全自动样品快速研磨仪(JXFSTPRP?24L,上海净信实验设备科技部,China);全自动核酸提取仪(Auto?Pure32A,杭州奥盛仪器有限公司,China);普通PCR扩增仪(T100,BIO?RAD,Singapore);荧光定量PCR仪(CFX Connect,BIO?RAD,Singapore);紫外?可见光分光光度计(Nanodrop2000,Thermo,USA);微孔板迷你离心机(BE?6100,海门市其林贝尔仪器制造有限公司,China);光学粘性封膜B(MSB1001,Bio?rad,USA);低位裙边96孔板(透明)(HSP9601,Bio?rad,USA)。
甲基纤维素(批号C2004046,上海阿拉丁生化科技股份有限公司,China);普纳替尼(批号13771,MedChemExpress,USA);邻联茴香胺(批号MKBX3619V,Sigma,USA);二甲基亚砜(DMSO,批号BCCD8942,Sigma,Switzerland);无水乙醇(批号20210901,国药集团化学试剂有限公司,China);30%H2O2(批号H2206859,上海阿拉丁生化科技股份有限公司,China);
无水乙酸钠(批号F20090306,国药集团化学试剂有限公司,China);ChamQ Universal SYBR qPCR Master Mix(批号027E2201CD,Vazyme,China);FastKing cDNA第一链合成试剂盒(去基因组)(批号X0320,天根生化科技(北京)有限公司,China);预装磁珠法通用型RNA提取试剂盒C(批号TL2210001643C,佛山奥维生物科技有限公司(ONREW),China)。
检测方法
2.1.MTC测定
随机选取5dpf黑色素等位基因突变型Albino品系斑马鱼于6孔板中,每孔(实验组)均处理30尾斑马鱼。分别水溶给予汉麻仁抗血栓肽(浓度见表7),同时设置正常对照组和模型对照组,每孔容量为3mL。除正常对照组外,其余各实验组均水溶给予普纳替尼建立斑马鱼血管内皮损伤模型,28℃处理18h后,测定汉麻仁抗血栓肽对模型斑马鱼的MTC。
2.2.治疗血管内皮损伤性血栓功效评价
随机选取5dpf黑色素等位基因突变型Albino品系斑马鱼于6孔板中,每孔(实验组)均处理30尾斑马鱼。分别水溶给予汉麻仁抗血栓肽(浓度见表8),阳性对照阿司匹林50.0μg/mL浓度,同时设置正常对照组和模型对照组,每孔容量为3mL。除正常对照组外,其余各实验组均水溶给予普纳替尼建立斑马鱼血管内皮损伤模型,28℃处理18h后,用邻联茴香胺进行染色,染色结束后,每个实验组随机选取10尾斑马鱼置于解剖显微镜下拍照,用NIS?ElementsD3.20高级图像处理软件分析并采集数据,分析统计斑马鱼心脏红细胞染色强度,以该指标的统计学分析结果评价汉麻仁抗血栓肽治疗血管内皮损伤性血栓功效。
统计学处理结果采用mean±SE表示。用SPSS26.0软件进行统计学分析,p<0.05表明差异具有统计学意义。
2.3.血管内皮损伤性血栓血流动力学改善功效评价
随机选取5dpf野生型AB品系斑马鱼于6孔板中,每孔(实验组)均处理30尾斑马鱼。分别水溶给予汉麻仁抗血栓肽(浓度见表9),阳性对照阿司匹林50.0μg/mL浓度,同时设置正常对照组和模型对照组,每孔容量为3mL。除正常对照组外,其余各实验组均水溶给予普纳替尼建立斑马鱼血管内皮损伤模型,28℃处理18h后,每个实验组随机选取10尾斑马鱼置于心跳血流分析系统下录制斑马鱼血流视频,分析统计斑马鱼血流速度,以该指标的统计学分析结果评价汉麻仁抗血栓肽血管内皮损伤性血栓血流动力学改善功效。统计学处理结果采用mean±SE表示。用SPSS26.0软件进行统计学分析,p<0.05表明差异具有统计学意义。
2.4.血管内皮损伤性血栓节间血管直径改善功效评价
随机选取5dpffli?1品系斑马鱼于6孔板中,每孔(实验组)均处理30尾斑马鱼。分别水溶给予汉麻仁抗血栓肽(浓度见表10),阳性对照阿司匹林50.0μg/mL浓度,同时设置正常对照组和模型对照组,每孔容量为3mL。除正常对照组外,其余各实验组均水溶给予普纳替尼建立斑马鱼血管内皮损伤模型,28℃处理18h后,每个实验组随机选取10尾斑马鱼在荧光显微镜下拍照,用NIS?ElementsD3.20高级图像处理软件分析并采集数据,分析斑马鱼节间血管直径,以该指标的统计学分析结果评价汉麻仁抗血栓肽血管内皮损伤性血栓节间血管直径改善功效。统计学处理结果采用mean±SE表示。用SPSS26.0软件进行统计学分析,p<0.05表明差异具有统计学意义。
2.5.血管内皮损伤性血栓改善功效机制研究
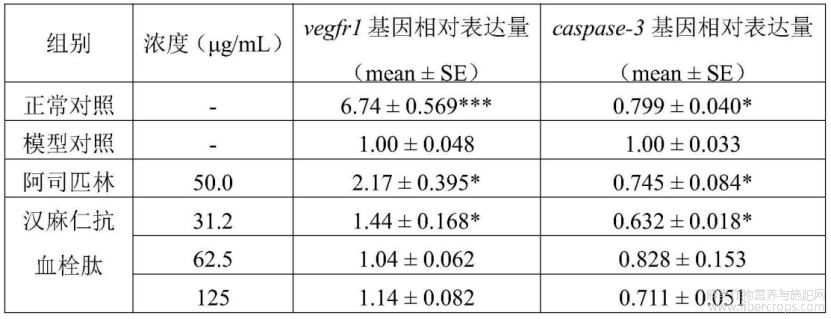
随机选取5dpf野生型AB品系斑马鱼于6孔板中,每孔(实验组)均处理30尾斑马鱼。分别水溶给予汉麻仁抗血栓肽(浓度见表11),阳性对照阿司匹林50.0μg/mL浓度,同时设置正常对照组和模型对照组,每孔容量为3mL,每个实验组设置三次平行实验。除正常对照组外,其余各实验组均水溶给予普纳替尼建立斑马鱼血管内皮损伤模型。28℃处理12h后,使用全自动核酸提取仪提取各组斑马鱼总RNA,利用紫外?可见光分光光度计对总RNA浓度和纯度进行测定。取2.00μg斑马鱼样品总RNA,按照cDNA第一链合成试剂盒说明操作,合成20.0μLcDNA,通过q?PCR检测β?actin、vegfr1和caspase?3基因的表达。用β?actin作为基因表达的内参,计算vegfr1和caspase?3基因的RNA相对表达量。统计学处理结果采用mean±SE表示。用SPSS26.0软件进行统计学分析,p<0.05表明差异具有统计学意义。
3.检测结果
3.1.MTC
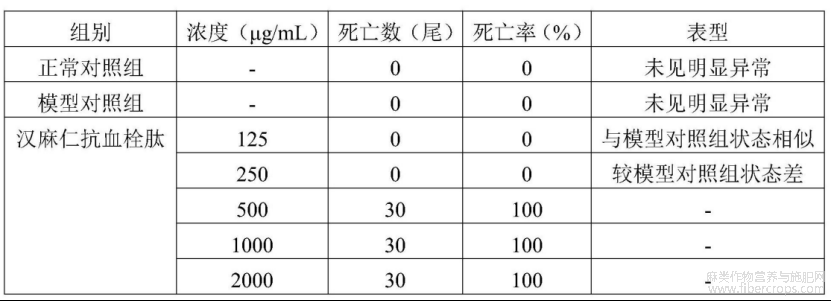
在本实验条件下,汉麻仁抗血栓肽血管内皮损伤最大检测浓度(MTC)为125μg/mL。
详见表7。
表7 汉麻仁抗血栓肽血管内皮损伤浓度摸索实验结果(n=30)
3.2.治疗血管内皮损伤性血栓功效评价
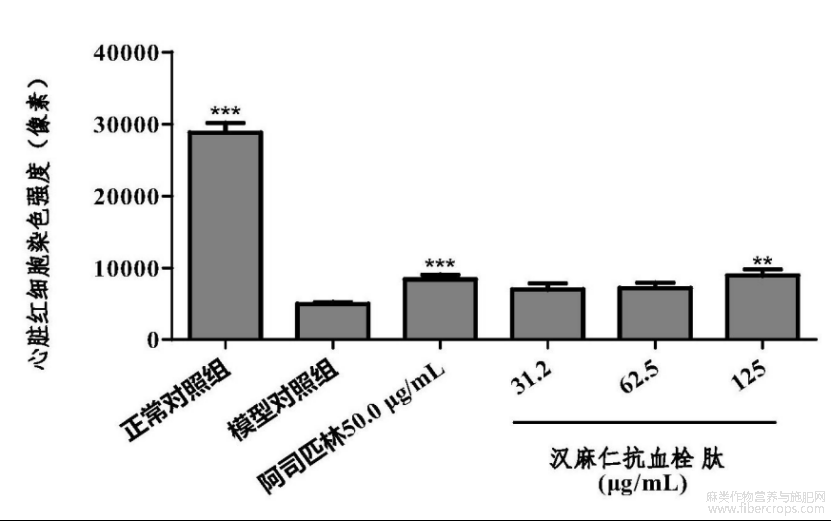
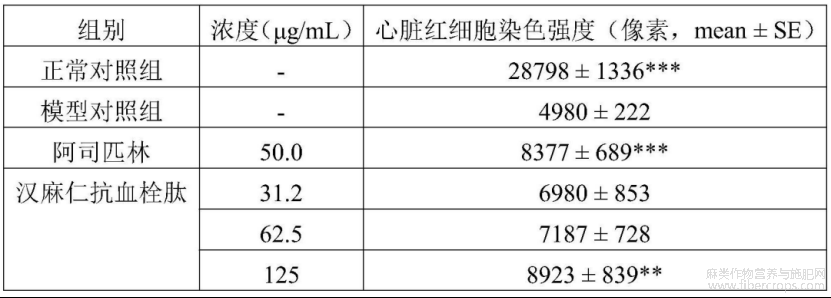
在本实验条件下,汉麻仁抗血栓肽有治疗血管内皮损伤性血栓功效,表现为增加心脏红细胞染色强度。详见表8、图9?图16。图9?图15中蓝色虚线框处为分析部位斑马鱼心脏,图16中,与模型对照组比较,**p<0.01,***p<0.001。
表8 汉麻仁抗血栓肽治疗血管内皮损伤性血栓功效评价实验结果(n=10)
与模型对照组比较,**p<0.01,***p<0.001
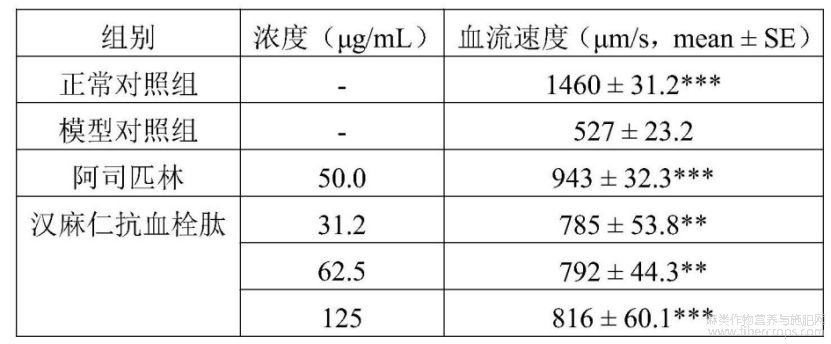
3.3.血管内皮损伤性血栓血流动力学改善功效评价
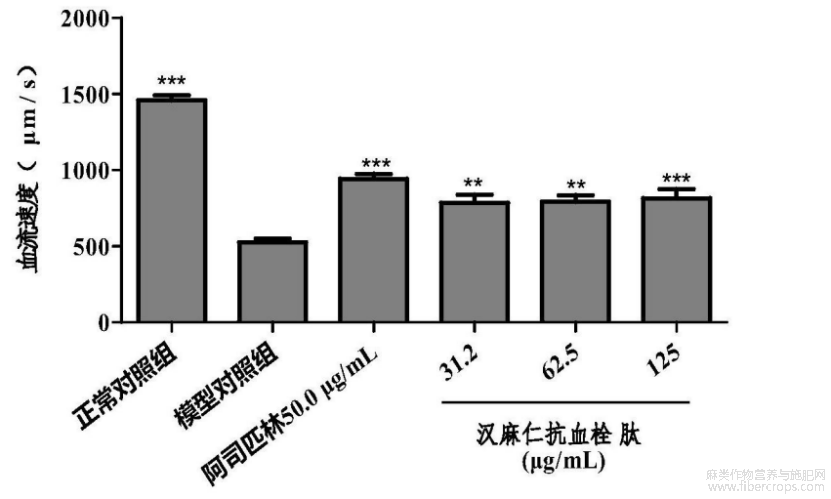
在本实验条件下,汉麻仁抗血栓肽有改善血流速度功效。详见表9和图17。图17中,与模型对照组比较,**p<0.01,***p<0.001
表9 汉麻仁抗血栓肽血管内皮损伤性血栓血流动力学改善功效评价实验结果(n=10)
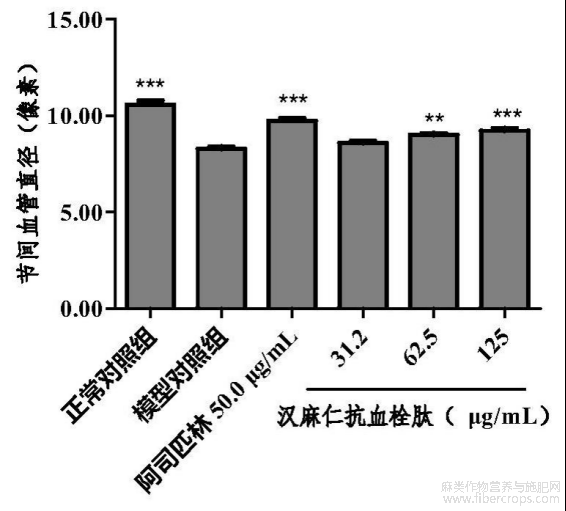
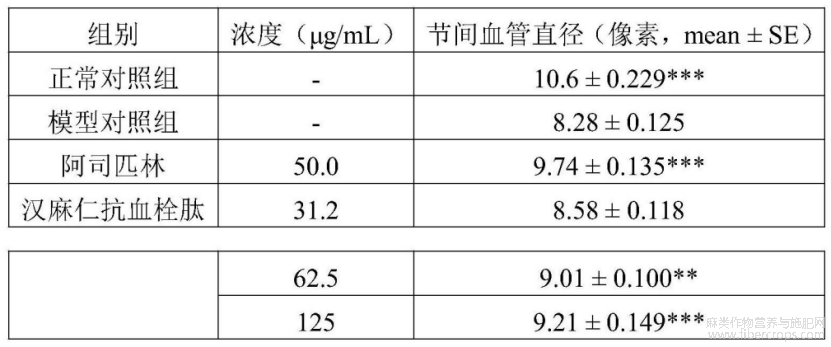
在本实验条件下,汉麻仁抗血栓肽具有血管内皮损伤性血栓节间血管直径改善功效。详见表10、图18和图19~24。图18?图24中,黑色虚线框内为斑马鱼节间血管分析区域,图25中,与模型对照组比较,**p<0.01,***p<0.001
表10 汉麻仁抗血栓肽血管内皮损伤性血栓节间血管直径改善功效评价实验结果(n=10)
与模型对照组比较,**p<0.01,***p<0.001
3.5.1.RNA提取结果及引物序列信息
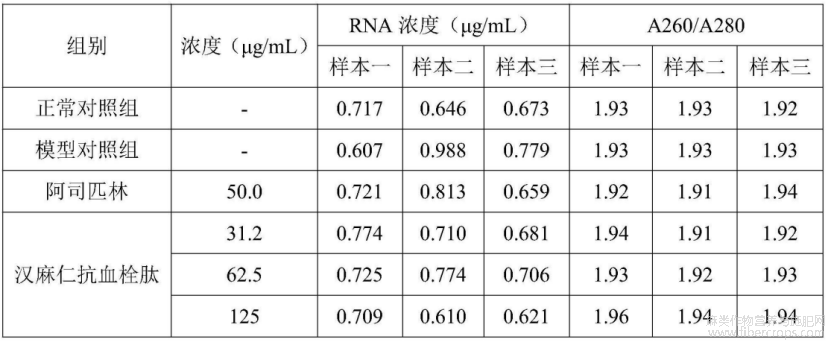
在实验终点,提取斑马鱼总RNA,用紫外?可见光分光光度计测定RNA的浓度及A260/A280比值(表11),A260/A280比值均在1.8?2.2之间,表明提取得到斑马鱼总RNA质量较好,可用于后续q?PCR实验。引物序列见表12。
表11 总RNA的浓度及A260/A280比值(n=3)
表12 引物序列信息
3.5.2血管内皮损伤性血栓改善功效机制研究
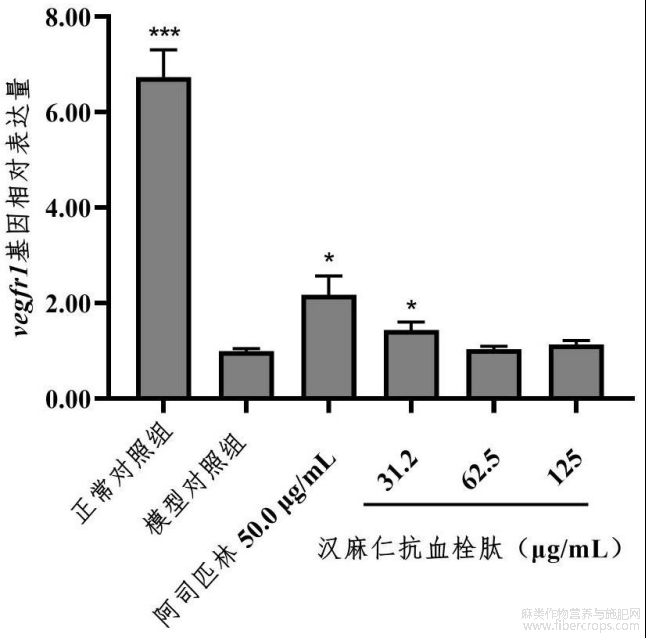
VEGF通过和其受体VEGFR结合,调节血管生成。VEGFR1主要在血管内皮细胞中表达,当其与VEGF蛋白结合后,胞内信号转导区的酪氨酸发生磷酸化,从而激活细胞内信号通路,导致血管内皮细胞的生长、增殖和成熟,促进新生血管的生成。Caspase?3可诱导内皮细胞的凋亡,刺激内皮细胞合成血小板活化因子,从而引起血小板聚集。
在本实验条件下,汉麻仁抗血栓肽能上调vegfr1基因相对表达量,下调caspase?3基因相对表达量。详见表13、图26和图27。图26中,与模型对照组比较,*p<0.05,***p<0.001,图27中,与模型对照组比较,*p<0.05。
表13 汉麻仁抗血栓肽血管内皮损伤性血栓改善功效机制研究实验结果(n=3)
与模型对照组比较,*p<0.05,***p<0.001。
摘自国家发明专利,石杰,董艳,魏连会,张正海,姬妍茹,李国巍,杨庆丽,潘静,高媛,李柏阳,高宇,申请号:202311583578.X,申请日:2023.11.24