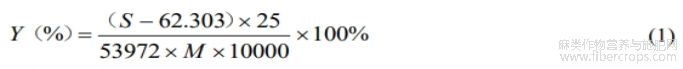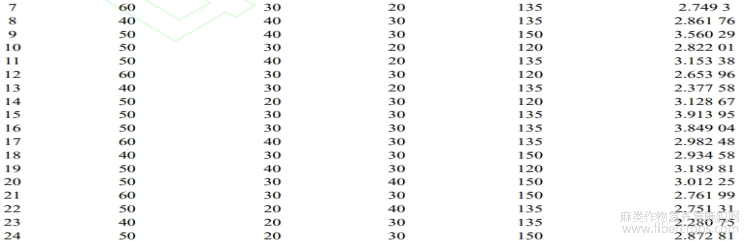摘 要: 为了解决大麻二酚酸(CBDA)传统提取工艺效率低、生长期和光质调控对其含量影响不明确等问题,试验遵循高效提取、精准调控理念,采用响应面法优化CBDA提取工艺,并考察光质调控“汉麻11号”不同生长期CBDA含量变化。根据单因素试验并结合响应面法考察液料比、提取温度、提取时间和超声波功率对CBDA含量的影响,确定最佳提取工艺并对理论结果进行验证。结果表明,CBDA最佳提取工艺为液料比50:1(mL/g),提取温度33℃,提取时间32min,超声波功率135W,该条件下CBDA百分含量为3.885%,与验证结果(3.91±0.07)%基本一致,相比于以往文献报道方法提升了9.83%。光质调控研究表明,红色:绿色:蓝色=79.88%:4.01%:16.11%的光质条件下,初花期CBDA成分含量最高。该研究为CBDA的光质调控和最佳采收期提供了技术依据,有望提高CBDA的应用价值。
关键词:工业大麻;大麻二酚酸;提取工艺;光质调控;不同生长期;最佳采收期
工业大麻(Industrial hemp)属一年生大麻科大麻属草本植物[1]。大麻二酚(CBD)是工业大麻中主要的非精神活性成分,近年来国际上对其进行的研究逐渐深入。大麻二酚酸(CBDA)是CBD的生物合成前体,在特殊频段光照、高温加热、储存过程等条件下发生脱羧反应转变成CBD。研究发现,CBDA具有降低食欲、减轻体重[2]、治疗犬类疾病[3-4]、治疗自闭症[5]、治疗精神分裂[6]、保肝[7]等功效,并具有一定的抗病毒活性[8]。
人工光源室内栽培植物相比于大田种植,生长环境稳定且可调控。针对植物生长需求进行光质调控,能够实现形态建成以及目标活性成分的靶向积累。对室内栽培植物不同生长期中目标成分含量进行监测,对确定最佳采收期、合理施肥、质量控制以及开发利用等方面有重要指导意义和应用价值[9-11]。
目前在大麻素成分的分析中,CBD提取方法较为成熟,然而并没有CBDA的精确提取方法。由于CBDA的稳定性较差,在一些条件如:特殊频段光照、高温加热等情况下,可以脱羧转变为CBD[12],因此CBD提取条件中对温度、超声波功率等的要求并不同样适用于CBDA。为了降低因提取条件导致CBDA脱羧转化造成的含量损失,尽可能精确地分析工业大麻中CBDA的含量,本文在CBD提取方法的研究基础上,探究不同液料比、提取温度、提取时间、超声波功率下CBDA的提取效果,采用超声辅助提取并结合响应面法优化了CBDA的提取方法,并以此方法对光质调控不同生长期的CBDA含量变化进行测定,明晰CBDA在工业大麻生长周期中的成分动态积累过程,明确其成分积累最大值时的生长期,进而确定最佳采收期,为大麻花叶的深入开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
工业大麻原料由黑龙江省科学院大庆分院提供;甲醇:色谱纯,北京百灵威科技有限公司;乙腈:色谱纯,北京百灵威科技有限公司;CBDA标准溶液:质量浓度100μg/mL,上海西格玛奥德里奇贸易有限公司;甲酸:色谱纯,上海阿拉丁生化科技股份有限公司;0.22μm针式有机相滤膜:天津市津腾实验设备有限公司;10mL一次性注射器:江苏宇治医疗器材有限公司。
1.2 仪器与设备
LC-15C高效液相色谱仪:岛津公司;Inertsoil ODS-3(150mm×4.6mm,3μm)色谱柱:岛津公司;TDL-80-2B型离心机:上海安亭科学仪器厂;KQ3200DE型数控超声波清洗器:昆山市超声仪器有限公司;PTX-FA110型电子天平:福州华志科学仪器有限公司;A11-B-S025型粉碎机:德国IKA公司;HP320型光谱照度计:杭州双色智能检测仪器有限公司。
1.3 方法
1.3.1 取样方法
2023年7月采自黑龙江省科学院大庆分院试验基地种植的“汉麻11号”植株叶片(花穗),取样部位为植株主茎顶端叶片(花穗),阴干脱水并4℃条件下保存待测。
1.3.2 供试品溶液的制备
按照文献记载方法[13-15],在以往工艺条件上进行微调。将待测样品充分研磨粉碎,称取0.1g置于10mL离心管中,加入5mL甲醇溶液,放置于超声波清洗器中以150W功率40℃提取30min,然后以转速1000r/min离心2min,充分移取上清液过0.22μm有机相滤膜,置于容量瓶中。重复提取3次,合并提取液,定容至25mL,即得供试品溶液。
1.3.3 HPLC 检测方法的建立
(1)标准溶液的配置
用CBDA标准溶液配置出浓度分别为0.6、3、6、30、60μg/mL的标准溶液,过0.22μm有机相滤膜后待测。
(2)高效液相色谱条件
色谱柱:Inertsoil ODS-3(150mm×4.6mm,3μm)色谱柱,以V(乙腈):V(水)=78:22为流动相进行等度洗脱,流速0.7mL/min,检测波长220nm,柱温30℃,进样量10μL,分析时间20min。
1.3.4 方法学考察
(1)线性关系试验
将各浓度的标准溶液按照“1.3.3(2)”的条件进行HPLC检测。分别以各标准浓度(μg/mL)为横坐标x,以峰面积为纵坐标y,绘制出CBDA标准曲线。
曲线方程为y=53972x+62.303,R²=0.9998,线性范围为0.5~100(μg/mL),检测限(LOD)为0.05μg/mL,定量限(LOQ)为0.15μg/mL。
(2)精密度试验
将0.6、6、30μg/mL浓度的标准品溶液按照“1.3.3(2)”的条件分别连续进样5次,记录峰面积。
(3)稳定性试验
将阴干、粉碎后的样品按照“1.3.2”条件进行供试品溶液的制备,4℃避光条件下保存,分别于制备后的0、1、3、6、10、16、24h按照“1.3.3(2)”的条件进样,记录CBDA峰面积。
(4)重复性试验
将阴干、粉碎后的样品8份,按照“1.3.2”条件进行供试品溶液的制备,按照“1.3.3(2)”的条件进样,记录CBDA峰面积。
(5)加样回收率试验
准确量取8份已知CBDA含量的供试品溶液10mL,分别加入6μg/mL的CBDA标准品溶液1mL,混合均匀后按照“1.3.3(2)”的条件进样,记录CBDA峰面积。
(6)含量计算方法
按公式(1)计算CBDA百分含量Y:
式中:S—峰面积;25—溶剂体积,mL;M—样品实际干重,g;10000—换算系数。
1.3.5 单因素试验
参照1.3.2方法,考察液料比(10:1、20:1、30:1、40:1、50:1、60:1、70:1)(mL/g)、提取温度(20、30、40、50、60℃)、提取时间(10、20、30、40、50min)、超声波功率(75、90、105、120、135、150W)对CBDA百分含量的影响。
1.3.6 响应面优化试验
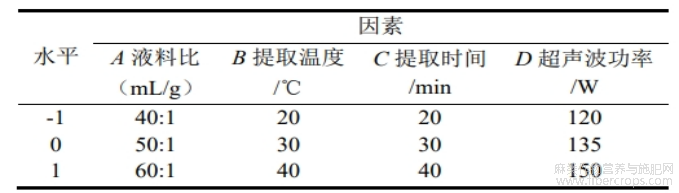
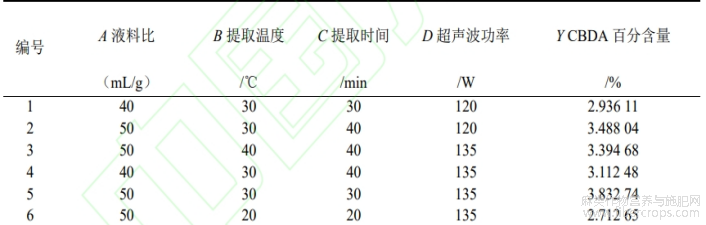
基于单因素试验结果,采用Design-Expert13软件设计Box-Behnken Design试验,以液料比、提取温度、提取时间、超声波功率为试验因素,CBDA百分含量为响应值,设计4因素3水平的响应面优化试验,试验设计如表1所示。
表1 响应面因素与水平设计
1.3.7光质调控不同生长期工业大麻CBDA含量测定
韦秀叶[16]研究了不同光谱对工业大麻CBD产量的影响,但并未对CBDA含量进行研究,本文参考其光谱,选择了4种光质调控条件,并对其影响下不同生长期大麻CBDA含量进行测定。
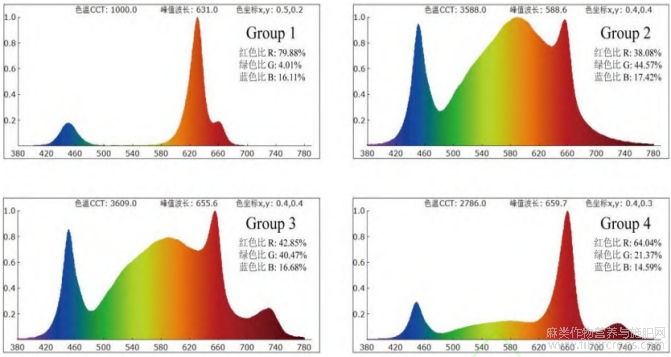
样品于2023年7—9月采自黑龙江省科学院大庆分院培育的“汉麻11号”品种。Group1~4分别生长于4种光质调控室内育种间,使用HP320型光谱照度计检测光谱(图1),除光谱不同外,其他培育条件均一致。研究表明[17],蓝光会延长花叶成熟期,本文4个光质中蓝色光占比基本相同,因此没有对花期和生长阶段产生影响。取样时各光质育种间内的植株均处于相同的生长阶段。监测周期从种子萌发后的第15天开始,第一次取样时间记录为0d,此时植株处于苗期,取样部位为顶端叶片,之后每7天取样一次,每一个光质调控室内育种间取样30株并进行混合,样品采集后阴干脱水并4℃条件下保存。取样时间、部位以及物候期见表2。
表2 取样时间、部位以及物候期
图1 4种光质调控室内育种间光谱
注:蓝光峰值460nm;绿光峰值530nm;红光峰值660nm。
将所有待测样品以响应面优化后的最佳条件:液料比50:1(mL/g)、提取温度33℃、提取时间32min、超声波功率135W进行超声波辅助提取,制备供试品溶液。按照“1.3.3(2)”的条件进样,进行样品测定,记录峰面积,计算CBDA含量。
1.3.8 数据处理
利用Excel软件记录并整理试验数据,结果以`x±SD(x≥3)表示,运用SPSS27.0软件进行单因素方差分析(One-Way ANOVA),采用Waller-Duncan事后校验,P<0.05表示存在显著性差异。采用Origin2021绘制折线图、响应面图、柱形图以及瀑布图,运用R-studio绘制热图。
2 结果与分析
2.1 CBDA 液相色谱分析
2.1.1 CBDA 液相色谱分析图
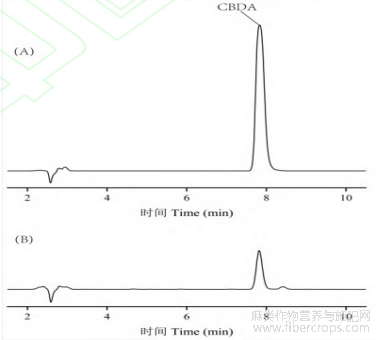
按照“1.3.3(2)”条件将CBDA标准品和供试样品进行HPLC分析,如图2所示。CBDA保留时间为7.731min。在本团队以往研究中表明,此液相色谱条件可应用于工业大麻花叶提取液的定性及定量分析[18]。
图2 CBDA 标准品(A)和样品(B)色谱图
2.1.2 方法学考察
(1)精密度考察
经过计算,三种浓度CBDA标准品峰面积的RSD值分别为0.89%、0.52%、0.72%,证明此方法的精密度良好。
(2)稳定性考察
经过计算,CBDA峰面积的RSD值为2.48%,证明此方法提取的供试品溶液4℃避光条件下在24h内的稳定性良好。
(3)重复性考察
经过计算,CBDA峰面积的RSD值为3.75%,证明此方法的重复性良好。
(4)加样回收率考察
经过计算,CBDA平均回收率为98.59%,RSD值为3.98%,证明此方法准确可靠。
2.2 单因素试验结果分析
2.2.1 液料比对 CBDA 百分含量的影响
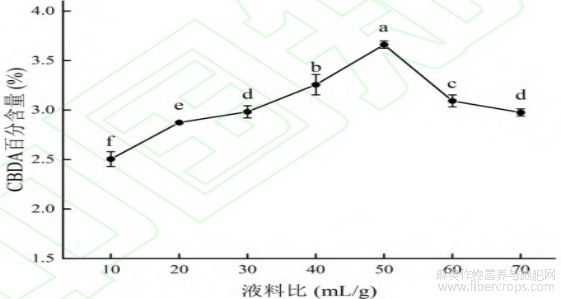
由图3可见,液料比在10:1~50:1(mL/g)区间内CBDA百分含量随液料比的增大呈逐渐上升状态,在液料比为50:1(mL/g)时达到最大值,之后,CBDA百分含量随液料比的增加呈下降状态。推测液料比少于50:1(mL/g)时,CBDA在少量的溶剂中呈现出溶解饱和状态,导致样品中的CBDA未能完全提取,而液料比过高对溶剂需求量更大,会造成不必要的资源浪费[19]。因此,确定液料比为50:1(mL/g)。
图3 液料比对 CBDA 百分含量的影响
注:各指标中不同字母表示差异显著(P<0.05),n=3
2.2.2 提取温度对 CBDA 百分含量的影响
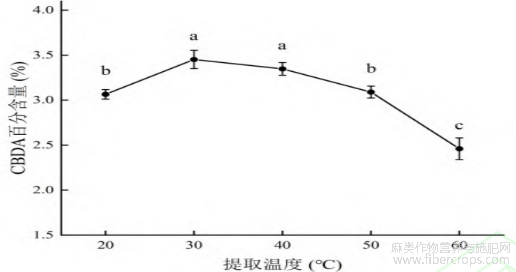
由图4可见,提取温度由20℃上升到30℃时,CBDA百分含量有所提高,说明在30℃以下,CBDA未实现充分提取,随着温度的升高,CBDA百分含量逐渐降低。由于CBDA的热稳定性较差,高温易发生脱羧反应[20]。因此,确定30℃为适宜提取温度。
图4 提取温度对 CBDA 百分含量的影响
2.2.3 提取时间对 CBDA 百分含量的影响
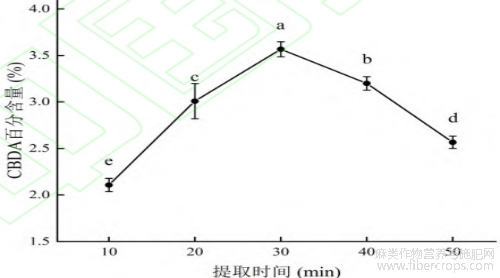
由图5可见,10~30min的提取过程中CBDA百分含量逐渐升高,30~50min的过程中随着提取时间的加长,CBDA百分含量呈下降趋势。提取时间太短会导致有效成分未能实现充分提取,在溶液体系达到平衡后,继续超声波提取不会提高有效成分的溶出,且长时间的超声波产生的热效应会使体系温度升高,导致CBDA发生脱羧反应,含量降低[21]。因此,确定提取时间为30min。
图5 提取时间对 CBDA 百分含量的影响
2.2.4 超声波功率对 CBDA 百分含量的影响
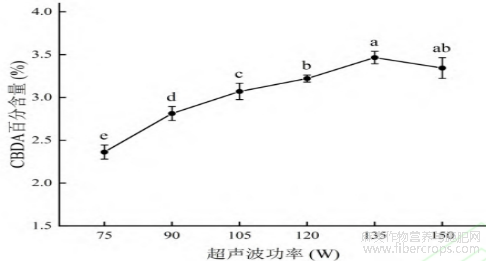
由于功率超过135W后,CBDA百分含量已呈下降趋势。且有研究表明[22-23],超声功率过大会促使CBDA脱羧。因此没有考虑150W以上的超声波功率对CBDA百分含量的影响。超声波功率在75~135W时,CBDA百分含量随功率增大而上升,135W时达到百分含量最大值,之后,随超声波功率的增大而下降(图6)。因此,确定超声波功率为135W。
图6 超声波功率对 CBDA 百分含量的影响
2.3 响应面试验结果分析
2.3.1 响应面试验结果
基于单因素试验结果,以液料比(A)、提取温度(B)、提取时间(C)和超声波功率(D)为响应变量,以CBDA百分含量(Y)为响应值,根据响应面法中的Box-Behnken Design试验方法,设计4因素3水平试验,试验结果见表3。
表3 Box-Behnken Design 试验设计及结果
2.3.2 回归方程拟合方差分析
运用Design-Expert13软件对试验数据进行多元回归拟合,得二次方程模型:CBDA百分含量Y=3.83—0.0183A+0.2536B+0.1232C+0.0144D+0.0123AB—0.1751AC+0.0274AD+0.0507BC+0.1566BD—0.2257CD—0.7408A²—0.4341B²—0.3884C²—0.263D²。
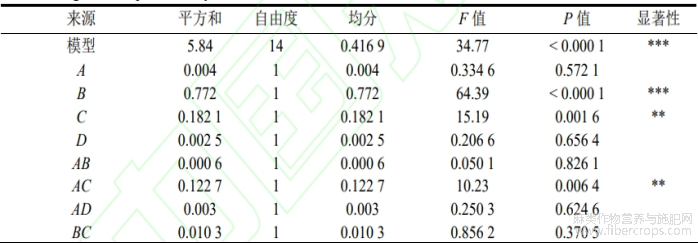
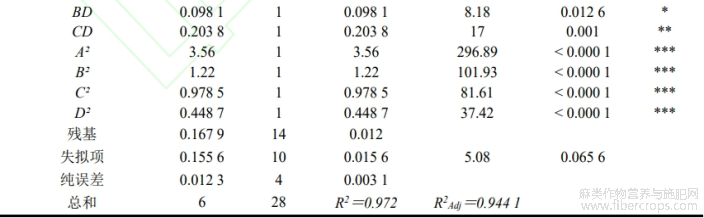
回归方程的分析结果见表4。P<0.0001,可知模型极显著;失拟项P=0.0656>0.05,失拟项不显著;决定系数R2=0.972,调整后的决定系数R2Adj=0.9441,可知回归方程的相关性较好,拟合度良好,证明该试验方法可靠性和可信度较高,可以应用该模型来预测和分析大麻中CBDA的百分含量。由表中F值可以看出,4个因素对样品中CBDA百分含量的影响程度为:提取温度(B)>提取时间(C)>液料比(A)>超声波功率(D)。方程一次项中对大麻中CBDA百分含量的影响,提取温度(B)达到了极显著水平(P<0.0001),提取时间(C)达到了极显著水平(P<0.01),可知提取温度对样品中CBDA百分含量的影响较大,提取时间次之;在两两交互项中AC和CD项极显著(P<0.01),BD项显著(P<0.05),可知液料比和提取时间、提取时间和超声波功率两两交互作用对样品中CBDA百分含量的影响较大,提取温度和超声波功率两两交互作用次之;A2、B2、C2、D2这4个二次项对样品中CBDA百分含量的影响均极显著(P<0.0001)。
表 4 回归方程方差分析
注:*P<0.05;**P<0.01;***P<0.001。
2.3.3 响应面分析
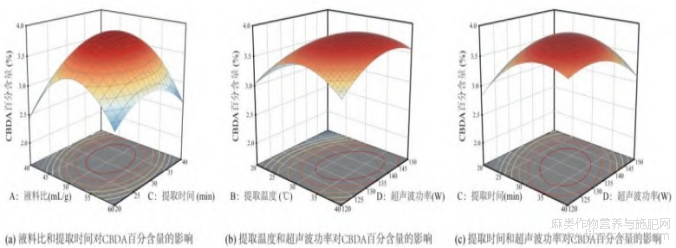
因素之间两两相互作用对响应值产生的影响可以通过响应面图形的形状直观地呈现出来,响应面的曲度越大,其投影出的二维等高线椭圆的离心率越大,此两两因素的交互作用对于响应值的影响越显著[24]。由图7可见,AC、BD、CD两两交互形成的响应面曲度较大,坡面陡峭,等高线皆呈椭圆形,证明AC、BD、CD这三组两两交互作用对工业大麻中CBDA百分含量的影响较大,结论与“2.3.2”中回归方程方差分析的结果相一致。
图7 各因素的交互作用对 CBDA 百分含量的影响
2.3.4 最佳工艺参数
利用Design-Expert13软件对工业大麻中CBDA的提取工艺进行优化,通过数据分析,得到最佳工艺参数为:液料比49.706:1(mL/g),提取温度33.1℃,提取时间31.732min,超声波功率135.648W,在此条件下样品中CBDA百分含量为3.885%。考虑实际操作的限制,将工艺参数进行调整:液料比50:1(mL/g),提取温度33℃,提取时间32min,超声波功率135W,以此条件对样品中CBDA进行5次平行提取试验,得到的提取率为(3.91±0.07)%,误差率为0.64%,证明该法可靠。
2.4 光质调控不同生长期工业大麻中 CBDA 含量
在以响应面法优化了分析过程中CBDA提取方法的基础上,对光质调控不同生长期工业大麻CBDA含量进行分析。
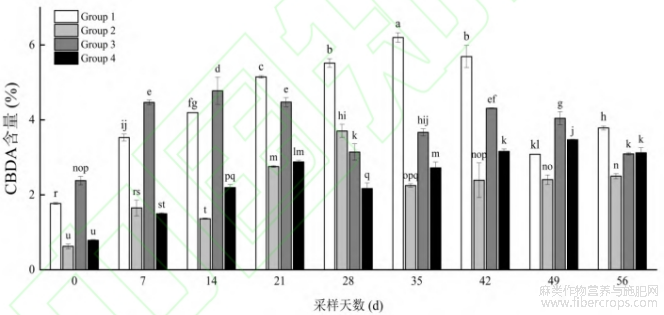
CBDA是CBD的生物合成前体,在特殊频段光照、高温加热等情况下,可脱羧转变为CBD。因此,在对工业大麻中CBD含量进行评估时应同时分析CBD与CBDA的含量。由图8可知,Group1光质条件下35d取样的工业大麻中CBDA含量最高,为6.20%,显著高于其他光质条件和生长期(P<0.05),其次为与35d取样时间前后间隔各7d的28d(生长期)和42d(盛花期)样品,CBDA含量分别为5.52%和5.67%,显著高于其他光质条件和生长期(P<0.05)。
图8 CBDA 含量
CBDA是CBD的生物合成前体,在特殊频段光照、高温加热等情况下,可脱羧转变为CBD。因此,在对工业大麻中CBD含量进行评估时应同时分析CBD与CBDA的含量。由图8可知,Group1光质条件下35d取样的工业大麻中CBDA含量最高,为6.20%,显著高于其他光质条件和生长期(P<0.05),其次为与35d取样时间前后间隔各7d的28d(生长期)和42d(盛花期)样品,CBDA含量分别为5.52%和5.67%,显著高于其他光质条件和生长期(P<0.05)。
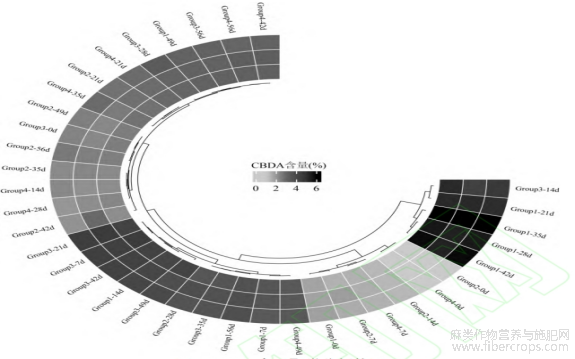
将CBDA含量进行聚类热图分析,由图9可见,各组测试结果分为三类,Group3的14d和Group1的21、28、35、42d这五组样品归为第一类,CBDA含量显著高于其他样品,其中Group1的28、35、42d样品CBDA含量又显著高于Group3的14d和Group1的21d样品。
图9 CBDA 含量聚类分析热图
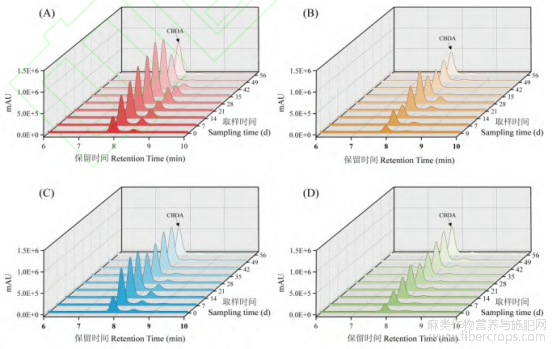
对各光质条件分别进行不同生长期CBDA含量分析与对比,由图10可见,Group1光质条件下整个生长周期内CBDA含量的积累明显高于其他三种光质条件,且图9聚类分析热图显示,成分含量最高的分类中三组试验数据均来自于Group1,图8也可明显看出Group1光质条件下CBDA含量相较于其他三种光质条件的显著性。
图10Group1(A)、Group2(B)、Group3(C)、Group4(D)不同生长期CBDA含量
3 讨论与结论
近年来对大麻素的研究主要围绕CBD展开,CBDA作为其生物合成前体,具有与之相似的功效,如抗炎、抗惊厥、止吐等[25]。但在BologninI等[26]的研究中发现,在抑制由毒素或运动引起的呕吐与惊厥反应方面,CBDA较CBD效果更佳。随着研究的不断深入,CBDA的应用前景将会非常广阔。本文基于CBD分析过程中提取方法研究基础,采用超声辅助提取结合响应面法优化了CBDA的提取方法。最佳工艺参数为:液料比50:1(mL/g),提取温度33℃,提取时间32min,超声波功率135W,利用此方法测试的CBDA量为(3.91±0.07)%,较文献记载方法[13]提升了9.83%。本研究不仅提高了CBDA的提取量,且降低了对提取温度和超声波功率的要求,更为节能和降低机器损耗。
郭孟璧等[27]采用红、黄、蓝和无色透明滤光膜对工业大麻进行处理并分析不同时期花叶中CBD含量,发现不同光质调控下CBD含量各不相同,证明光质调控能够影响工业大麻中大麻素的成分积累。本文运用优化后的提取工艺对光质调控不同生长期工业大麻CBDA含量进行比较分析,结果表明,4组光源中三色比为红色:绿色:蓝色=79.88%:4.01%:16.11%的光质条件下,CBDA成分积累最大,而此光质条件与其他三组的明显区别在于其绿色光占比极少,红、蓝光占比较多。工业大麻是喜阳植物[27],这与研究表明“红、蓝光更适于喜阳植物,蓝、绿光更适于喜荫植物的生长发育”的结论一致[28],推测红、蓝光能够促进CBDA的成分积累。在此光质条件下种子萌发后第35天初花期时CBDA含量最高,而初花期后CBDA含量的下降,可能是植株的继续生长过程中,大麻素成分由CBDA向CBD进行了转化。LISA等[24]将工业大麻生长期分为营养期、芽期、盛花期和种子成熟期4个阶段,并进行了CBDA含量的测定,研究显示,芽期和盛花期CBDA含量显著高于其他两个阶段。本文研究结果与之一致,且更为细致地划分了生长期,并明晰了CBDA含量最高的生长阶段为初花期。因此,“汉麻11号”室内栽培光质条件为红蓝光比5:1,并在种子萌发后第35天初花期进行花叶采收,可确保CBDA成分含量最高。
参考文献
[1] 中国科学院中国植物志编辑委员会.中国植物志-第一卷-总论[M].北京:科学出版社,2004:223.
[2] Ben-cnaan E, Permyakova A, Azar S, et al. The metabolic efficacy of a cannabidiolic acid (CBDA) derivative in treating diet- and genetic-induced obesity[J]. International Journal of Molecular Sciences, 2022, 23(10): 5610.
[3] Court M H, Mealey K L, Burke N S, et al. Cannabidiol and cannabidiolic acid: Preliminary in vitro evaluation of metabolism and drug–drug interactions involving canine cytochrome P-450, UDP-glucuronosyltransferase, and P-glycoprotein[J]. Journal of Veterinary Pharmacologyand Therapeutics, 2024, 47(1): 1-13.
[4] Klatzkow S, Davis G, Shmalberg J, et al. Evaluation of the efficacy of a cannabidiol and cannabidiolic acid rich hemp extract for painin dogs following a tibial plateau leveling osteotomy[J]. Frontiers in Veterinary Science, 2023, 9: 1036056.
[5] Giorgi V, Vila A, Fernandez S, et al. Treatment with high cbda Cannabis sativa extract revertsautistic-like phenotypes differentially between sexes in two asd mice models[J]. IBRO Neuroscience Reports, 2023, 15: S128.
[6] Richardson B, Clarke C, Blundell J, et al. Therapeutic-like activity of cannabidiolic acid methyl ester in the MK-801 mouse model of schizophrenia: Role for cannabinoid CB1 and serotonin-1A receptors[J].European Journal of Neuroscience, 2024, 59(9): 2403-2415.
[7] Giralt A, Batchuluun B, Willows R, et al. Cannabidiolic acid (CBDA) regulates energy homeostasis and protects against non-alcoholic fatty liver disease (NAFLD) in mice[J]. Journal of Hepatology, 2023, 78: S762.
[8] Tamburello M, Salamone S, Anceschi L, et al. Antiviral activity of cannabidiolic acid and its methyl ester against SARS-CoV-2[J]. Journal of Natural Products, 2023, 86(7): 1698-1707.
[9] Sankhuan D, Roytrakul S, Nakano M, et al. Proteomic sensing associated with terpenoid biosynthesis of Artemisia annua L. in response to different artificial light spectra[J]. Journal of Plant Interactions, 2022, 17(1): 19-32.
[10] Hwang M H, Seo J W, Park B J, et al. Evaluation of growth characteristics and biological activities of ‘dachul’, a hybrid medicinalplant of Atractylodes macrocephala × Atractylodes japonica, under different artificial light sources[J]. Plants, 2022, 11(15): 2035.
[11] ZHENG C, MA J-Q, MA C-L, et al. Regulation of growth and flavonoid formation of tea plants (Camellia sinensis) by blue and green light[J]. Journal of Agricultural and Food Chemistry, 2019, 67(8): 2408-2419.
[12] 蔡宏达,刘梦然,王崑仑,等.工业大麻中大麻二酚酸脱羧转化体系研究[J].天然产物研究与开发,2024,36(2):303-313.
[13] 张旭,孙宇峰,田媛,等.SPE-HPLC法同时测定汉麻提取物中3种大麻酚含量[J].化学试剂,2018,40(6):547-550.
[14] 陈国峰,尤宏梅,王贵江,等.高效液相色谱法同时测定工业大麻中四种大麻素的方法研究[J].黑龙江农业科学,2021(11):60-64.
[15]蔡宏达.工业大麻中大麻二酚转化规律与绿色提取工艺研究[D].哈尔滨:东北林业大学,2023.
[16] 韦秀叶.工业大麻工厂化生产关键技术研究[D].北京:中国农业科学院,2021.
[17] Burgel L, Hartung J, Pflugfelder A, et al. Impact of growth stage and biomass fractions on cannabinoid content and yield of differenthemp (Cannabis sativa L.) genotypes[J]. Agronomy, 2020, 10(3): 372.
[18] 高宝昌,田媛,石雨,等.微波辐射和物理加热对大麻素酸脱羧反应影响对比分析[J].分析试验室,2021,40(9):1049-1052.
[19] 王君,高文彬,陈新,等.响应面法优化金丝皇菊多酚提取工艺及其抗氧化活性评价[J].粮食与油脂,2024,37(1):79-84.
[20] Citti C, Pacchetti B, Vandelli M A, et al. Analysis of cannabinoids in commercial hemp seed oil and decarboxylation kinetics studies of cannabidiolic acid (CBDA)[J]. Journal of Pharmaceutical and Biomedical Analysis, 2018, 149: 532-540.
[21] Abenante L, Penteado F, Vieira M M, et al. Ultrasound-enhanced Ag-catalyzed decarboxylative coupling between α-keto acids and disulfides for the synthesis of thioesters[J]. Ultrasonics Sonochemistry, 2018, 49: 41-46.
[22] Some S, Han Yong Bae Mun Jong Kim, ZHANG Y J, et al. Ultrasound-promoted enantioselective decarboxylative protonation of α-aminomalonate hemiesters by chiral squaramides: a practical approach to both enantiomers of α-amino esters[J]. European Journal of Organic Chemistry, 2017, 2017(31): 4562-4565.
[23] Ansari R, Kirpalani D M. Insightsinto ultrasound-promoted degradation of naphthenic acid compounds in oil sands process affected water. Part I: Accelerated H-abstraction and decarboxylation of aromatic and alicyclic compounds[J]. Ultrasonics Sonochemistry, 2022, 83: 105929.
[24] 陈炯朝,马雪,张研,等.响应面法优化超声辅助低共熔溶剂提取洋蓟花苞多糖工艺[J].中国食品添加剂,2024,35(4):57-64.
[25] FORMATO M, CRESCENTE G, SCOGNAMIGLIO M, et al. (?)-cannabidiolicacid, a still overlooked bioactive compound: an introductory review and preliminary research[J]. Molecules, 2020, 25(11): 2638.
[26] BOLOGNINI D, ROCK E M, CLUNY N L, et al. Cannabidiolic acid prevents vomiting in Suncus murinus and nausea-induced behaviour in rats by enhancing 5-HT1A receptor activation[J]. British Journal of Pharmacology, 2013, 168(6): 1456-1470.
[27] 郭孟璧,陈璇,郭鸿彦,等.不同光质对工业大麻生长及其抗癫痫成分大麻二酚积累的影响[J].中药材,2019,42(10):2220-2225.
[28] SONG Y L,LIU W C, WANG Z, et al. Effect of different monochromatic LEDs on the environmental adaptability of Spathiphyllum floribundum and Chrysanthemum morifolium[J]. Plants, 2023, 12(16): 2964.
文章摘自:石雨,李国巍,张婧如,田媛,张治国,高宝昌.工业大麻中大麻二酚酸(CBDA)含量测定方法优化及光质调控分析[J/OL].中国麻业科学.https://link.cnki.net/urlid/43.1467.S.20250220.1919.004。