摘 要:罗布麻中含有大量糖苷和苷元类黄酮成分,具有不同药理活性和药代动力学行为,对其分级是阐明药效物质基础的重要途径。针对罗布麻中的黄酮类成分建立溶剂诱导相变(SIPT)分级方法,考察不同种类有机溶剂和无机盐作为诱导剂对罗布麻中糖苷和苷元分离行为的影响。当V(乙腈)∶V(水)=1∶1时,加入体积分数为25%三氯甲烷诱导分相后,水相中的主要峰经液相色谱质谱鉴定为糖苷类化合物。SIPT分级的机理是通过向乙腈水溶剂中加入小体积与水不溶的有机溶剂或盐溶液,从而使原本与水互溶的乙腈相从水-有机溶剂混合相中实现萃取分离;而无机盐参与萃取诱导的行为可以归结为盐析效应。将SIPT应用于汉麻中,加入体积分数为15%三氯甲烷时,获得了良好的分相效果,SIPT法较好地实现了麻类中黄酮苷和苷元的分级。
关键词:罗布麻;溶剂诱导分相;黄酮;苷元;分级;液相色谱
中药是中华民族瑰宝,在诸多疾病的治疗过程中发挥着重要作用。中药是一个复杂的体系,含有极多的化学成分,如皂苷类、黄酮类、多酚、萜类、甾类等[1],其中,罗布麻(Apocynum venetum L.)为夹竹桃科罗布麻属植物。现代药理研究表明,罗布麻叶具有降血压、降血脂、抗抑郁、增强免疫、抗衰老等作用[2-3]。
罗布麻叶中含有黄酮类、脂肪酸类、萜类、甾醇类、有机酸和挥发性成分等重要的活性成分[4],主要药效活性基础成分为黄酮类、黄烷类及其黄酮苷类[5]。大多数黄酮苷元在水中存在溶解性差、生物利用度低等问题,从而导致人体对黄酮类药物吸收慢、药效不显著,极大地限制了临床应用[6-7],给黄酮类新药的寻找与开发带来相当大的困难。黄酮类成分(包括糖苷及其苷元)具有不同药理活性和药代动力学行为,因此对糖苷及苷元分级进行研究是阐明中药药效物质基础的重要途径。汉麻、工业大麻等麻类植物中含有大麻二酚等活性成分,其中还含有芦丁等[8]黄酮类成分,这些成分对于大麻二酚等成分的纯化造成了较大干扰,使纯化工艺复杂,导致产物成本较高。此外,这些成分回收利用对于生物质资源开发以及从副产物中生产高附加值药物中间体等具有重大意义。
传统的中药化学分离方法包括:不同极性的溶剂提取、大孔树脂分类脱色吸附提取、硅胶柱分级纯化、高效液相色谱法纯化等[9-12]。常规提取的方法难以区分糖苷和苷元,柱色谱方法可以纯化各个单体化合物,但这可能降低中药的协同作用[13],且柱色谱方法成本较高。因此,如何快速有效地将糖苷和苷元分离是亟待解决的问题。溶剂诱导相变(Solvent-Induced Phase Transition,SIPT)是一种新的样品预处理方法,类似于从人血浆中同时测定多拉司酮及其主要代谢产物羟多拉司酮的盐诱导相分离提取法(Salt-Induced Phase Separation Extraction,SIPSE)[14]。
糖苷和苷元存在极性差异,在水中和有机相中的溶解度有所不同。水和乙腈原本是互溶的溶剂,当引入特定的无机盐、糖、非极性溶剂,可以产生相变分层,具有能够区分糖苷和苷元的潜力[14],因此,本文以罗布麻和汉麻为样品,考察合适的溶剂诱导相变条件,进而开发罗布麻中糖苷和苷元的分级方法,为罗布麻中药效成分的活性评价和生物医药开发奠定良好的基础。
1 实验部分
1.1 材料与试剂
罗布麻,苏州当地药材店;汉麻,齐齐哈尔大学黑龙江省工业大麻加工技术创新中心。甲醇、乙醇,分析纯,上海泰坦科技股份有限公司;三氯甲烷、二氯甲烷、正丁醇,分析纯,上海凌峰化学试剂有限公司;氯化钠,纯度≥99.5%,上海阿拉丁生化科技股份有限公司。
1.2 仪器设备
Waters2965高效液相色谱仪配置2996DAD检测器、Empower色谱工作站,美国Waters公司;RE-501型旋转蒸发仪,巩义予华仪器厂;Expert-18k台式高速离心机,湖南吉尔森科技发展股份有限公司;KQ500B型超声波清洗器,昆山市超声仪器有限公司。
1.3 样品预处理
将采集的罗布麻叶放入50℃烘箱中烘干60min,烘干后使用粉碎机粉碎,过100目筛网,称取50g罗布麻粉末,加入500mL乙醇溶液,超声30min,超声功率为150W。提取后减压抽滤得到乙醇提取液,对乙醇提取液旋蒸浓缩,喷雾干燥后结块得到罗布麻醇提物备用。称取6.0g罗布麻醇提物,加入120mL乙腈水溶剂(体积比1∶1),超声萃取30min,离心8000r/min,10min,取上清液4.0mL,分别加入0.2,0.4,0.6,0.8,1.0mL诱导剂,反复颠倒混匀后,离心6000r/min,10min后观察分层情况,分别测定水相和有机相中的总糖苷含量,以峰面积比计算糖苷回收率。
1.4 HPLC色谱条件
色谱柱:MultohypODS-5μm,4.6mm×250mm,德国CS色谱服务有限公司;流动相:A.水,B.乙腈;梯度程序:0~15min,5%B~65%B;16~30min,65%B~95%B;流速:1mL/min;柱温:25℃;检测波长:265nm;进样量:10μL。
2 结果与讨论
2.1 溶剂诱导分相的溶剂考察
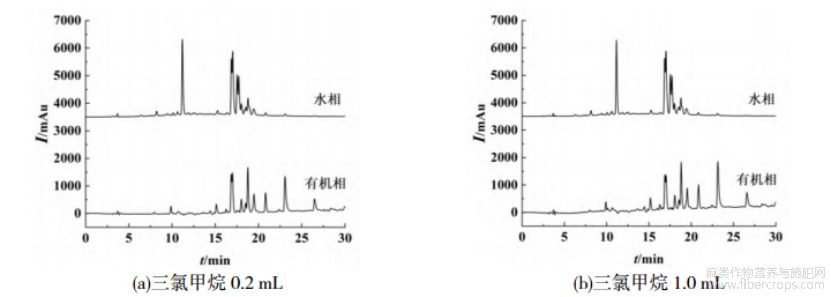
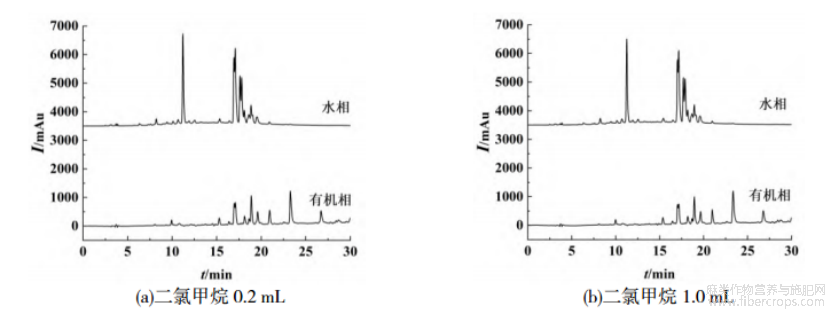
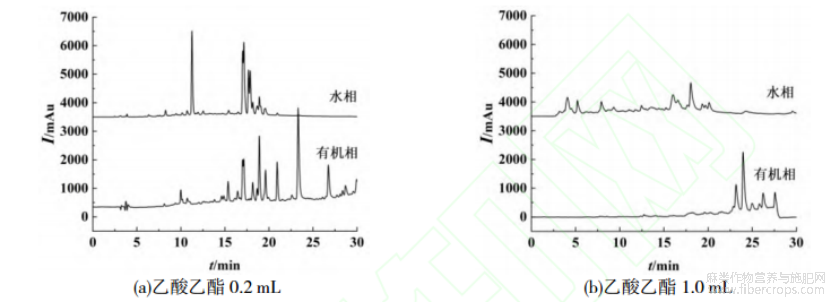
本文考察三氯甲烷、二氯甲烷和乙酸乙酯作为诱导剂对水和乙腈提取的罗布麻溶液进行诱导分相,对分相后的有机相和水相分别取样进行液相色谱分析,结果如图1~3所示。罗布麻成分复杂,水相和有机相中均含有较多的色谱峰,由图1,2可知,水相和有机相中有部分重叠峰,说明诱导分相未呈现理想的糖苷及苷元分级效果。糖苷在反相C18柱上的保留相对弱于苷元,良好的分相应呈现不同的谱图,如图1,2所示,水相层弱保留的峰相对较多,而有机相层的色谱峰相对较长的保留时间,可以判断初步具备了分离糖苷和苷元的效果。3种不同诱导剂的诱导效果不尽相同,并且由于诱导剂加入量不同导致分相效果也不同,保留时间在18min前的峰主要存在于水相中,当二氯甲烷和三氯甲烷作为诱导剂时,水相中该峰的峰高明显大于有机相中,说明这两种诱导剂具有更好的诱导分相效果,其中三氯甲烷优于二氯甲烷。
图1 三氯甲烷体积对分相效果的影响
图2 二氯甲烷体积对分相效果的影响
图3 乙酸乙酯体积对分相效果的影响
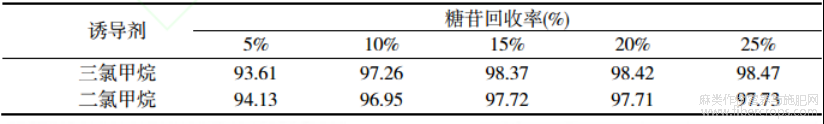
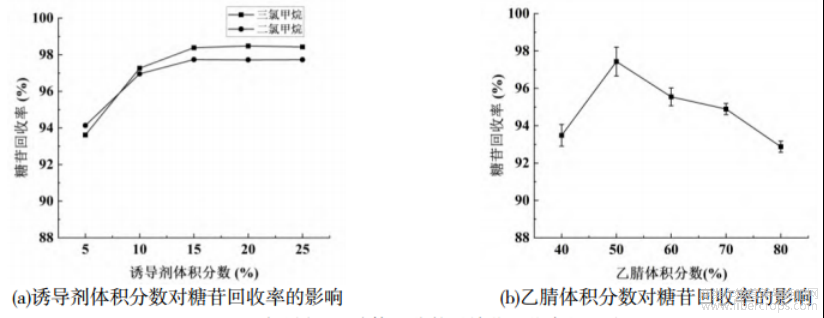
本文系统探讨了三氯甲烷和二氯甲烷两种有机溶剂及不同添加量对分相效果的影响。分层后,分别采集水相和有机相样本,并进样至液相色谱仪进行分析。以糖苷类化合物的总峰面积作为评估指标,量化评估不同诱导剂类型及添加量对分相效果的影响,结果如表1所示。由表1可知,随着诱导剂体积分数从5%增加到25%,水相中糖苷类化合物占总糖苷的比例逐渐增加,因诱导剂体积分数超过30%导致后续去除困难,本文诱导剂添加量为25%,此时回收率分别为98.47%(三氯甲烷)和97.73%(二氯甲烷)。诱导剂体积分数对糖苷类化合物水相回收率的影响趋势如图4(a)所示。此外,乙腈-水提取体系中乙腈和水体积比也影响糖苷和苷元的分离效果。以25%三氯甲烷为诱导剂,考察乙腈-水体积比对糖苷回收率的影响,结果如图4(b)所示。由图4(b)可知,乙腈体积分数从40%增加到80%的过程中,糖苷的回收率出现先增加后降低的现象,当乙腈和水体积比为1∶1时,糖苷的回收率最大。
表1 诱导剂种类和用量对回收率的影响
图4 诱导剂及乙腈体积分数对糖苷回收率的影响
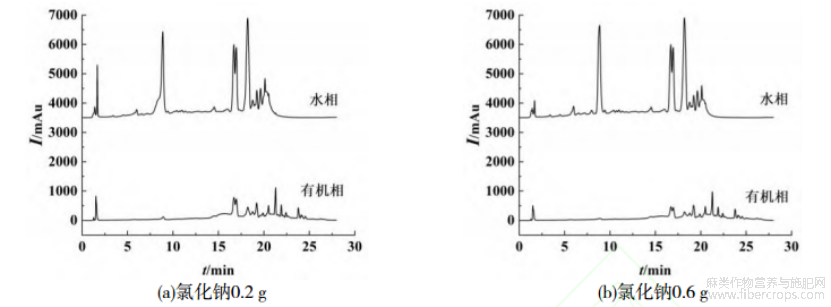
以氯化钠为诱导剂,氯化钠加入量为0.2,0.6g,诱导分相结果如图5所示。从保留时间为18min左右的峰在水相和有机相中来看,氯化钠作为诱导剂分相时,该峰在水相和有机相中峰高差异不大,说明氯化钠诱导分相对罗布麻无分级效果。
图5 不同添加量的氯化钠诱导分相对罗布麻中黄酮类成分的分级效果
通过盐析或者无机诱导剂改善萃取分离的方法已经得到广泛的应用[15-18],这主要取决于采用的萃取体系以及需要分离的物质对结构。由图1~3,5可知,与有机萃取诱导剂相比,无机诱导剂的效果明显不如有机诱导剂。这是由本文研究体系中分离的糖苷和苷类两类物质分子结构决定的。糖苷中含有糖基和苷元,糖基具有较强的亲水性,而苷元的疏水性更强,尽管无机盐可以通过盐析将水和有机溶剂分层,但相对而言,糖苷在水中溶解度能力增加,有机相对于苷的溶解能力改善有限,因此效果不明显。
2.2 溶剂诱导分相对罗布麻黄酮分级的优化条件及结果
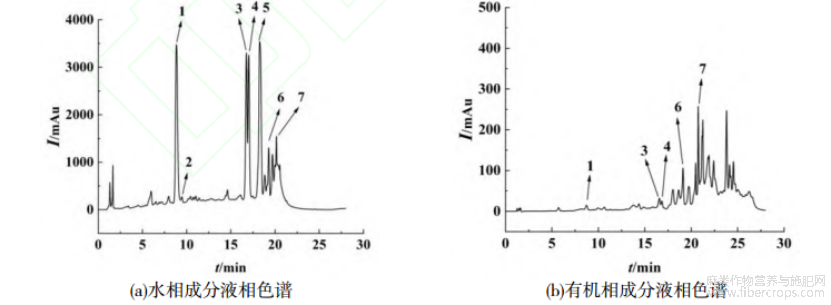
经过溶剂诱导分相条件考察,确定罗布麻叶中黄酮类成分提取-分级的最佳条件为:6.0g罗布麻醇提物粉末,加入120mL溶剂,V(乙腈)∶V(水)=1∶1,超声溶解30min,离心4500r/min,10min,取上清液加入体积分数为25%三氯甲烷进行诱导分相,水相层含较多的糖苷类物质。对水相层中的糖苷类进行液相色谱质谱(LC-QTOF/MS)定性检测,确定主要组分如图6所示。由此可见,诱导分相后,水相中的主要峰为糖苷类化合物。溶剂诱导分相法较好地实现了对罗布麻中黄酮苷和苷元的分级,为该类成分的药学活性评价和生物医药开发,以及对糖苷类成分的分离纯化等奠定良好基础。
图6 优化的溶剂诱导分相后水相和有机相罗布麻的LC-MS
注:1.绿原酸,2.白麻苷,3.异槲皮苷,4.金丝桃苷,5.槲皮素-3-(6''-丙二酰基)-葡萄糖苷,6.山奈酚-3-葡萄糖苷,7.槲皮素3-(6''-乙酰葡糖苷)。
2.3 溶剂诱导分相对罗布麻中黄酮苷和苷元分级的机理
有机溶剂作为诱导剂的萃取体系,小体积的诱导剂与有机溶剂形成新的有机相,新有机相与水相分层,
实现相分离,进而达到萃取的目的。无机盐参与萃取诱导的行为可以归结为盐析效应[15-18]。通过在体系中加入不同种类的盐,改变有机溶剂在水中的溶解度,直到实现分层,达到萃取的效果。本文分别采用无机和有机诱导剂在不同分离体系中的行为进行研究,初步阐明了诱导剂结构等对分离结果的影响,进一步拓展应用范围。
2.4 溶剂诱导分相对汉麻黄酮的分级结果
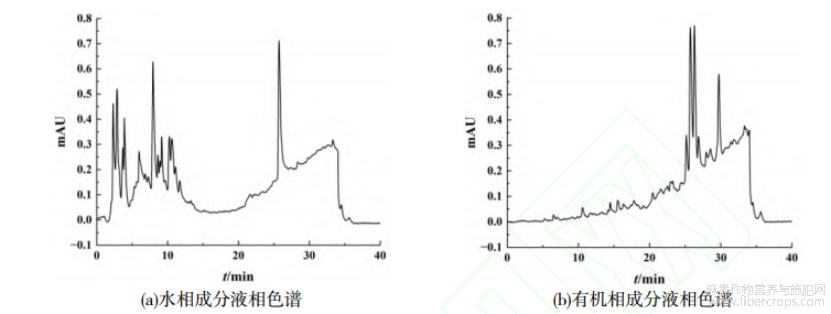
本文利用溶剂诱导相变法对汉麻中的成分进行分级探索,考察不同有机溶剂(三氯甲烷、二氯甲烷和正丁醇)和乙腈-水体积比对分相的影响,其中,二氯甲烷和正丁醇未出现分相现象,乙腈-水体积比对三氯甲烷诱导分相影响不大。此外,样品类型对于诱导分相体系有一定选择性。对于汉麻,少量三氯甲烷即可达到良好的分相效果,结果如图7所示。由图7可知,当V(乙腈)∶V(水)=1∶1时,15%三氯甲烷诱导体系下,大部分组分出现在水相层,为糖苷类成分。因汉麻化学成分研究较少,市售对照品少等局限,本文未作进一步鉴定。
图7 三氯甲烷诱导分相对汉麻中化学成分的分级效果
综上,有机诱导剂诱导有机溶剂的分层,这一现象可以理解为少量有机诱导剂将大量有机溶剂从水有机溶剂混合相中萃取出来,形成新的有机相,进一步实现目标组分的分离。相较于萃取溶剂,诱导剂的疏水性更强,在本文中更容易使苷从有机相中分离。
3 结论
本文探索了罗布麻叶中黄酮类化合物糖苷与苷元的分级方法,通过向乙腈-水溶液体系中加入三氯甲烷诱导分相实现在水相中富集糖苷的方法。乙腈与水的体积比影响糖苷的回收率,在乙腈体积分数为50%时,糖苷回收率较高;在所考察的二氯甲烷、三氯甲烷和乙酸乙酯3种有机诱导剂和氯化钠无机诱导剂中,三氯甲烷添加量为25%时,糖苷回收率较高,达98.47%,在罗布麻和汉麻黄酮苷与苷元的分级中达到较好的效果。此外,本文从物理化学层面探讨了有机与无机诱导剂分相的机理,为拓展溶剂诱导分相的应用奠定了基础。
参考文献
[1]Gu X, Hao D, Xiao P. Research progress of chinese herbal medicine compounds and their bioactivities: fruitful 2020[J]. Chinese Herbal Medicine, 2022, 14(2): 171-186.
[2]Xie W, Zhang X, Wang T, et al. Botany, traditional uses, phytochemistry and pharmacology of Apocynum venetum L. (Luobuma): a review[J]. Journal of Ethnopharmacology, 2012, 141(1): 1-8.
[3]陈小露,刘起棠,张洁帅,等. 罗布麻叶的化学成分及药理作用研究进展[J]. 时珍国医国药,2022, 33(11): 2739-2742.
[4]Shen N, Wang T, Gan Q, et al. Plant flavonoids: classification, distribution, biosynthesis, and antioxidant activity[J]. Food Chemistry, 2022, 383: 132531.
[5]吴淑珍,何民友,李国卫,等. 不同产地罗布麻叶 UPLC 特征图谱及黄酮类成分含量测定[J]. 中国现代中药,2021, 23(4): 619-626.
[6]吴方,陈桂,曹政,等. 糖基化黄酮类化合物与肠道菌群的相互作用影响机体健康的研究进展[J]. 中国临床新医学,2021, 14(10): 970-975.
[7]李俊生,吕佳佳,王兴慧,等. 黄芩总黄酮及其单体的溶解性及体外经皮渗透性能研究[J]. 中草药,2014, 45(2): 200-207.
[8]成亮,孔德云,胡光. 工业大麻研究.I.甲醇提取物的石油醚萃取和正丁醇萃取部分的化学成分[J]. 中国医药工业杂志,2008(1): 18-21.
[9]李颖,赵增成,林树乾,等. 丹参主要化学成分及提取分离方法研究进展[J]. 中医药学报,2021, 49(1): 106-111.
[10]王丹丹,刘芫汐,左甜甜,等. 大孔吸附树脂及其在中药领域应用研究进展[J]. 中国药事,2022, 36(7): 826-835.
[11]沈喆安,侯英泽,赵耀焜,等. 中草药中黄酮类化合物的提取工艺及药理作用研究进展[J]. 微量元素与健康研究,2023, 40(6): 66-68.
[12]王佳琪,李敏敏,范蓓,等. 天然双黄酮提取分离方法及生物活性研究进展[J]. 中国食物与营养,2024, 30(9): 21-28.
[13]史文娟. 罗布麻和红三叶中多糖与黄酮的抗氧化活性研究[D]. 兰州:兰州大学,2021.
[14]Hu Y, Chen S, Chen J, et al. Optimization of sample pretreatment methods for simultaneous determination of dolasetron and hydrodolasetron in human plasma by HPLC-ESI-MS[J]. Journal of Chromatographic Science, 2012, 50(9): 785-791.
[15]Wan F, Kang T, Liu A, et al. Salt induced phase separation extraction of 2,3-butanediol from aqueous solutions: recovery and recycling of potassium triphosphate[J]. Process Biochemistry, 2023, 125: 222-231.
[16]Wei Z, Zhao X, Liu H, et al. Separation of acetonitrile/water with the combination of superwetting membrane and salt-induced phase separation[J]. Material Letter, 2024, 357: 135704.
[17]Gu Y, Shih P H. Salt-induced phase separation can effectively remove the acetonitrile from the protein sample after the preparative RP-HPLC[J]. Enzyme Microbial Technology, 2004, 35(6): 592-597.
[18]Le Q, Shong L, Shi Y. Extraction of erythromycin from fermentation broth using salt-induced phase separation processes[J]. Separation Purification Technology, 2001, 24(1): 85-91.
文章摘自:王子梵,姚振,初红涛,等.基于溶剂诱导相变萃取法麻类植物中糖苷与苷元的分级研究[J/OL].齐齐哈尔大学学报(自然科学版),2025,(01):2-7[2025-02-10].