摘要:本研究以罗布红麻种子和愈伤组织为外植体,采用不同浓度的秋水仙素进行诱变处理,通过出芽率、诱导率等指标测定,以及形态观察、DNA含量检测、根尖染色体计数、荧光FISH分析等,开展诱变植株倍性鉴定。结果表明,以浓度为0.1%的秋水仙素溶液浸泡罗布红麻种子24h,可获得较高的罗布红麻种子出芽率和植株形态变异率,种子出芽率达70.10%以上,植株形态变异率为14.21%,可以作为罗布红麻种子多倍体诱导的最佳方式。本研究创制了罗布红麻新种质和育种材料,为罗布红麻遗传改良研究提供理论依据。
关键词:罗布红麻;秋水仙素诱导;核型鉴定;荧光原位杂交;种质创制
罗布麻是夹竹桃科罗布麻属(Apocynum)的一类多年生宿根草本植物,具有分蘖能力强,适应范围广等特点(Li et al., 2023a)。中国分布的罗布麻主要有罗布红麻(Apocynum venetum L.)及罗布白麻(Apocynum hendersonii Hook.f.)2种,其中罗布红麻分布在长江、淮河、秦岭和昆仑山以北的广大地区,是防风固沙、减少水土流失和盐碱地改良的理想植物之一(姜黎等,2018; Li et al., 2023b)。除此以外,罗布红麻全身均可以入药,具有降血压、降血脂、镇静、安神等功效(许泽恭等,2021;Liu et al., 2022);其韧皮纤维也具强力大,柔软挺括滑爽、耐湿抗菌防腐、散热快和透气性好等特点,极具生态和经济双重效益(Huang et al., 2023)。中国的罗布麻仍主要处于野生状态。每年冬季,地上部分自然死亡,次年开春新生枝条从根蘖部位发生,尽管通过适度的刈割、平茬等能够刺激新生枝条的萌蘖和生长。但目前大部分野生资源处于株丛衰老、密度下降、低矮、稀疏的退化状态,单位面积产量很低,严重制约了罗布麻资源效益的发挥和当地经济的发展(Jiang et al., 2021)。此外,罗布红麻属高度自花授粉植物,天然杂交率在0.5%以下(Gao et al., 2019),优势杂交种创制与应用中存在的技术瓶颈,长期连续自花传粉容易导致品种衰退,严重制约了罗布红麻育种创新。因此,开展罗布麻资源综合评价与精准鉴定,通过引种驯化、遗传多样性保护以及新种质创制等技术措施,筛选出耐旱、耐盐碱、耐寒、耐高温、抗风沙能力强的生态修复型,以及株型紧凑、分枝少、光合效率高、耐盐碱性强、产量高、多抗的功能保健型或纤维型罗布麻新品种(系),对促进罗布麻产业发展,变资源优势为经济优势,带动区域经济发展具有重要意义。化学诱导法是多倍体育种工作中最常见的方法,具有适用范围广、操作简单、经济实惠和诱导率高的特点(武振华等,2005),用秋水仙素处理植物分裂旺盛的幼嫩部位可以使染色体数目加倍,从而获得多倍体。多倍体植株由于染色体数目的增加,其遗传多样性显著提高,植株具有抗逆性增强、内含物质增加、果实增大、无子果实、观赏价值和经济价值增加等价值(Corneillie et al., 2019; Madani et al.,2021)。本研究以罗布红麻种子和愈伤组织为材料,采用不同浓度的秋水仙素进行诱变处理,研究了诱变时间、秋水仙素处理浓度等因素对诱变率的影响,通过形态观察、DNA含量检测、根尖染色体计数及染色体荧光FISH分析等鉴定得到四倍体植株,为罗布红麻创制新种质提供依据,并为罗布红麻遗传育种新途径开发奠定了基础。
1. 结果与分析
1.1. 以种子为外植体的罗布红麻多倍体诱导
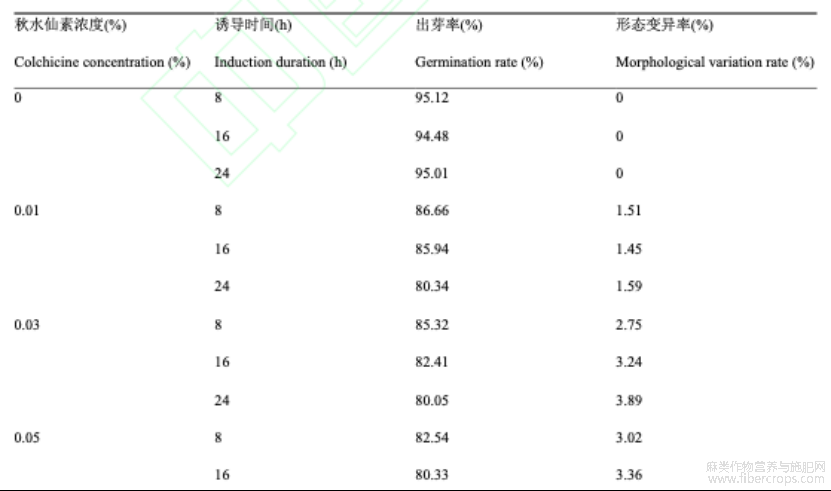
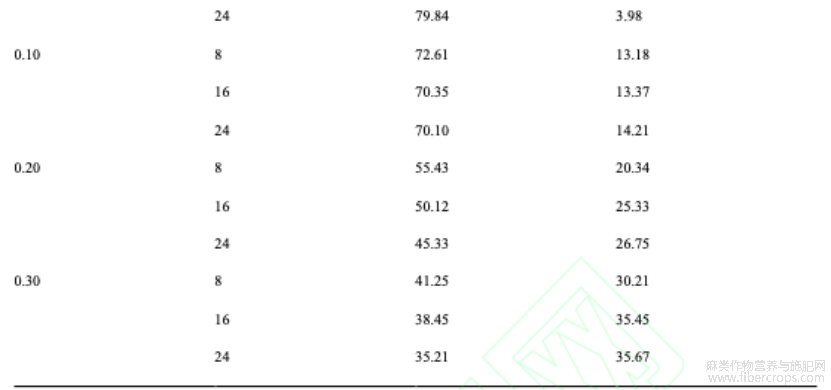
同一诱导时间下,罗布红麻种子出芽率随着秋水仙素浓度增加而显著降低,形态变异率随着秋水仙素浓度增加而显著增加,这表明高浓度的秋水仙素溶液具有抑制罗布红麻种子萌发而促进形态变异的作用,其中,当浓度增加至0.20%以上时,罗布红麻的出芽率较低,约为50%,且下降幅度最大,约为20%。同一秋水仙素浓度下,罗布红麻种子出芽率均随着诱导时间的增加而降低,形态变异率随着诱导时间的增加而增加,这表明增加诱导时间具有抑制种子萌发而而促进形态变异的作用,其中,当秋水仙素浓度增加至0.10%时,罗布红麻植株的形态变异率出现显著增加,增长幅度为10%,诱导时间为24h时的形态变异率为14.21%;未用秋水仙素处理的罗布红麻对照组具有最高的出芽率,约94.87%,形态变异率最低,为0%。
表1秋水仙素浸泡法对罗布麻种子的影响
注: 数值为3次重复的平均值
1.2. 以愈伤组织为外植体的罗布红麻多倍体诱导
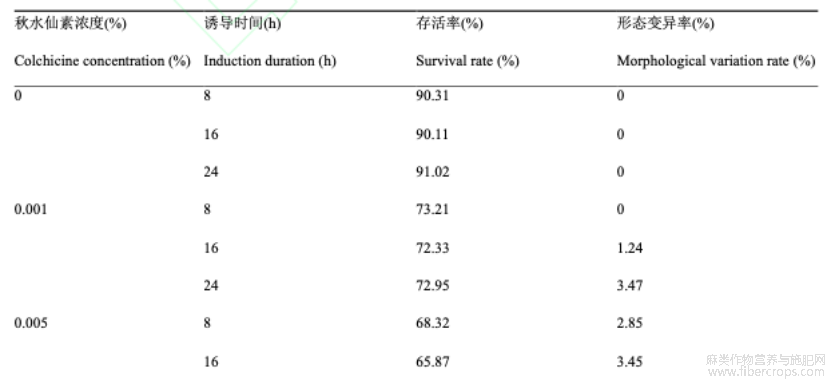
随着秋水仙素浓度升高和处理时间延长,植株存活率明显降低,培养20d后出现不定芽的变褐和死亡。未用秋水仙素处理的对照组不同诱导时间均未出现变异植株。当秋水仙素浓度为0.001%、处理时间8h时未诱导出多倍体,而其他处理组均可诱导出多倍体,形态变异率为1.24%~37.11%。其中0.08%秋水仙素处理24h时的形态变化率最高,为37.11%,但存活率最低,为10.21%。
表2秋水仙素混培法对罗布红麻愈伤组织形成的影响
注: 数值为3次重复的平均值
2. 罗布红麻多倍体的鉴定
2.1. 植株叶片形态学鉴定
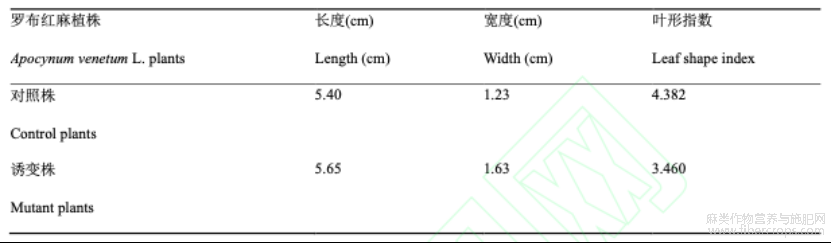
罗布红麻对照株与诱变株的形态特征结果显示(图1),罗布红麻诱变植株叶片的长度和宽度均高于二倍体对照植株,叶形指数则相反(表3)。对二者植株的整体形态观察,发现诱变株与二倍体植株相比,它的茎秆粗壮,叶片较厚,颜色较深,生长较缓慢。
图1罗布红麻二倍体对照株和诱变株叶片
注: A: 二倍体罗布红麻对照植株的老叶(上)和新叶(下); B: 罗布红麻诱变植株的老叶(上)和新叶(下)
表3罗布红麻二倍体对照株和诱变株叶片外形指数
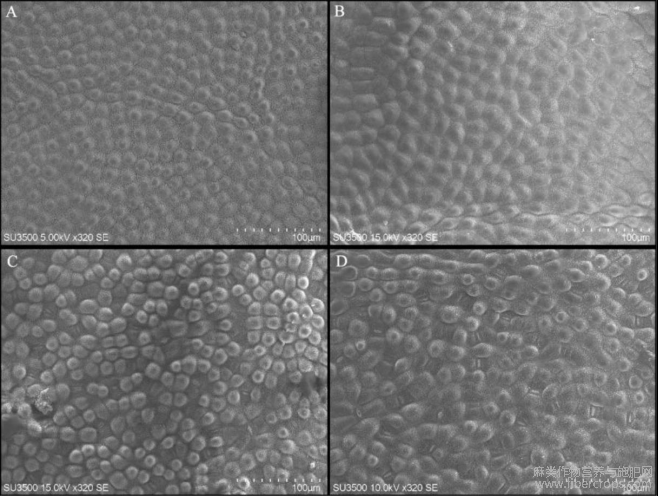
对罗布红麻对照株和诱变株叶片的正面、背面及气孔的扫描电镜观察(图2),发现与对照株相比,诱变株叶片的表皮细胞较大。经秋水仙素诱导处理后的多倍体植株的气孔大小及气孔密度均会发生变化,罗布麻的气孔主要分布在叶片背面,气孔的保卫细胞凹入叶片表面,且观察发现诱变株的保卫细胞的宽度和长度均大于对照株。
图2罗布红麻对照株与诱变株叶片及气孔的扫描电镜图
注: A: 对照株叶片正面; B: 诱变株叶片正面; C: 对照株叶片背面; D: 诱变株叶片背面
2.2. 体细胞DNA含量分析
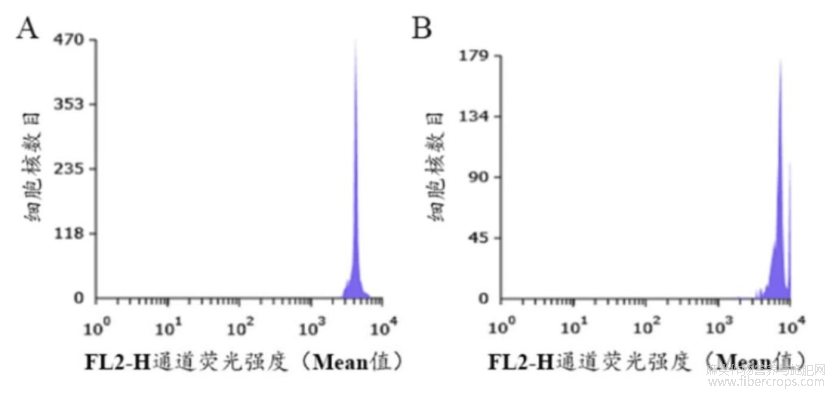
通过流式细胞仪观察植株在FL2-H荧光通道的荧光强度(DNA G0/G1峰),诱变株与对照株(二倍体)的DNA含量存在明显差异(图3)。对照株的DNA G0/G1峰位于4313.66通道,而诱变株的DNA G0/G1峰位于7201.72通道,这说明罗布红麻植株经过秋水仙素诱导处理后,其DNA相对含量约为普通二倍体植株的2倍,即该诱变株为四倍体。
图3罗布红麻细胞核DNA相对含量
注: A: 二倍体; B: 四倍体
2.3. 根尖染色体计数
通过压片法对罗布红麻二倍体和经流式细胞仪鉴定后的诱变株的幼嫩根尖进行染色体数目观察(图4),罗布红麻二倍体植株的染色体数目为2n=2x=22,经形态鉴定和流式细胞仪筛选出的罗布红麻四倍体植株的染色体数目为2n=4x=44。
图4罗布红麻染色体计数法鉴定(光学显微镜100)
注: A: 2n=2x=22; B: 2n=4x=44
2.4. 染色体核型分析与荧光FISH鉴定
染色体核型分析是确定染色体数目的重要手段之一。根尖染色体核型鉴定结果表明,二倍体罗布红麻植株的细胞染色体为2n=2x=22。经流式细胞仪鉴定过的诱变株的细胞染色体数为2n=4x=44,是二倍体植株染色体数目的2倍,证实该诱变株为四倍体(图5)。对罗布红麻二倍体与四倍体分别利用18SrDNA和5SrDNA重读序列探针进行荧光原位杂交,结果显示,在二倍体的22条染色体中,有1对5SrDNA信号;在四倍体的44条染色体中,有2对较明显的18SrDNA信号。
图5罗布红麻染色体核型荧光分析
注: A: 二倍体; B: 多倍体; DAPI染色为蓝色; 18SrDNA, 5SrDNA荧光原位杂交信号分别为绿色和红色
3. 讨论
罗布麻具有很高的药用价值、经济价值及生态价值,近年来,罗布麻资源面积逐渐萎缩,单位面积产量低,并且我国罗布麻的种类单一,严重制约了罗布麻资源的开发和利用。多倍体育种能够通过染色体加倍从而提高植物的产量及抗病性等,是新种质创制的有效方法。在本研究中,首先通过以不同的外植体为材料,设置了秋水仙素诱导浓度梯度及诱导时间,筛选出罗布红麻种子诱导多倍体的最适条件是以0.1%的秋水仙素浸泡种子24h,这能保证在具有较高的发芽率的同时具有较高的形态变异率。目前没有对罗布红麻多倍体诱导条件的研究报道,在其他植物的研究中发现不同植物种子诱导多倍体的秋水仙素处理的最适条件不同。李娟娟等(2022)用秋水仙素对黄连木(Pistacia chinensis)萌动种子进行浸泡时发现最佳诱导组合是0.2%的秋水仙素溶液浸泡36h和0.3%的秋水仙素溶液浸泡12h,其诱导率可达到38.10%。程志号等(2020)发现混培法下0.005%的秋水仙素培养5d是火龙果(Hylocereus undulatus britt)多倍体诱导的最佳条件。在本研究中发现,秋水仙素对种子等的毒性会随着处理时间和浓度的升高而增强,这与魏卓等(2020)的研究结果类似,推测秋水仙素的处理浓度和时间可能与种子的类型有关。同时研究发现秋水仙素浓度对罗布红麻种子出芽率及形态变异率的影响较大,同一浓度下处理时间对出芽率和形态变异率影响较小。0.1%和0.2%的秋水仙素浓度处理下,罗布红麻种子的出芽率降幅最大,但在同一秋水仙素浓度下,其发芽率、形态变异率最大仅相差10.1%和6.41%。综上所述,诱导罗布红麻多倍体最主要的是选择合适的秋水仙素处理浓度。多倍体鉴定一般通过形态学、细胞学及流式细胞仪等进行鉴定。本研究首先通过形态学和细胞学对罗布红麻诱变植株进行鉴定,筛选出茎杆粗、叶片大而厚,叶色深的诱变株,通过扫描电镜观察到诱变株与对照株相比,其气孔密度变小、保卫细胞变大,这与前人的研究相似(张虹等,2017;张广楠等,2021)。由于根尖的染色体之间相互重叠等导致难以数清染色体条数。形态学和细胞学鉴定快捷简便,但准确性不高,需要再进行进一步的鉴定。流式细胞仪、染色体核型分析可以准确直观地确定出染色体的条数,鉴定出植株的倍性。经鉴定,罗布红麻正常的二倍体植株染色体条数为22条,经过鉴定确定经过诱变的四倍体植株的染色体数为44条。与染色体核型分析相比,流式细胞仪方便快捷,通过植株G0/G1峰的细胞核DNA含量迅速准确地判断出同一物种的不同倍性,因此被普遍用于植株倍性鉴定。本研究最终成功诱导鉴定出的四倍体罗布红麻植株在形态上与二倍体植株差异显著,四倍体植株的茎更粗壮、叶片更厚更大、叶色更深,同时其叶片的细胞和气孔更大。在进行罗布红麻多倍体鉴定时,形态学鉴定可以作为筛选鉴定多倍体的有效方法之一,可以显著减少工作量。由于形态学鉴定的准确率较低,因此仍需通过流式细胞仪和染色体核型分析等手段进行进一步的鉴定。本研究成功诱导出罗布红麻四倍体,为罗布麻的新种质的研究提供了参考。
4. 材料与方法
4.1. 试验材料
本研究所用的罗布红麻种子来自于中国农业科学院麻类研究所国家种质资源谱,愈伤组织是由中国农业科学院麻类研究所的二倍体罗布红麻的叶片脱分化得到的。
4.2. 多倍体诱导处理
4.2.1. 浸泡法
将二倍体罗布红麻种子浸泡于0(对照)、0.01%、0.03%、0.05%、0.10%、0.20%、0.30%的秋水仙素无菌溶液中,在摇床(80~100r/min)上分别培养8h、16h、24h,共21个处理组合,每个处理设置3个重复。处理结束后,用无菌水冲洗3~4次,每次5min,用无菌滤纸吸干表面水分后播于穴盘。
4.2.2. 混培法
将秋水仙素加入到分化培养基(MS+0.5mg/LTDZ+0.03mg/L2,4-D+0.01mg/LIAA)中,配制成质量浓度为0.001%、0.005%、0.020%、0.040%、0.080%的诱导培养基,无菌水为对照,将愈伤组织接种到诱导培养基上,设置8h、16h、24h3个处理时间,处理结束后转入未加秋水仙素的普通分化培养基中培养,然后转至生根培养基(MS+0.01mg/LNAA)中进行生根培养。统计其出芽率和形态变异率。每个处理设置3个重复。
4.3. 多倍体鉴定方法
4.3.1. 形态学鉴定
根据诱变苗与二倍体罗布红麻的叶片形态特征,初步筛选出形态变异株。通过扫描电镜观察罗布红麻对照株和诱变株叶片表皮及气孔形态。
4.3.2. 流式细胞仪
取待测幼嫩罗布麻植株叶片50~100mg,置于预冷的平面玻璃板上,加入预冷的MgSO4解离液0.5~1mL,用刀片迅速切碎,于冰上放置5~10min,用300目的无菌细胞筛网过滤至预冷的EP管中,41000r/min离心8min,弃去部分上清后使剩余液体约为500μL,加入20μL的RNA酶混匀,冰上放置5min,避光加入50~100μL碘化丙锭(PI)染液冰上染色30min,用300目细胞筛网过滤到上样管中,用FACSCalibur流式细胞仪(美国BD公司)进行上机检测,每个样品收集20000个细胞核。
4.3.3. 根尖染色体计数
以幼嫩的根尖为材料制片,取10个嫩白色根尖(3~4mm)于3mL饱和对氯二苯中10~20处理2h,转入0.075mol/L的氯化钾溶液,室温处理30min,换入2.5%混合酶液(5%果胶酶+5%纤维素酶)室温酶解1h,期间轻摇2次。酶解完成后,用蒸馏水浸洗2次后迅速加入新鲜配置的甲醇-冰醋酸(3:1)固定液,固定30min以上。取2~3条根尖放于提前冰冻好的载玻片上,切去根尖上端1mm,制成烤片,在卡宝品红中染色5h以上,在Olympus显微镜下观察并拍照统计染色体数目。
4.3.4. 染色体核型分析与荧光FISH鉴定
分别取发芽后的罗布红麻普通二倍体植株和诱导多倍体植株活跃的分生组织(幼嫩根尖),用N2O处理诱导细胞有丝分裂,获得大量处于中期的细胞,进行染色体标本制作,通过高分辨率的显微镜和成像设备,观察到清晰而直观的染色体形态和数目。利用重复序列探针,通过荧光原位杂交实验,利用荧光显微镜观察,进行染色体组核型的精准鉴定。
参考文献
[1] Cheng Z.H., Sun C.J., Sun P.G., Guo S.X., and Wu Q., 2020, Optimization of polyploidy induction system in dragon fruit, Guoshu Xuebao (Journal of Fruit Science), 37(7): 1089-1097.(程志号,孙长君,孙佩光,郭素霞,吴琼,2020,火龙果多倍体诱导体系的优化,果树学报,37(7):1089-1097.)
[2] Corneillie S., De Storme N., Van Acker R., Fangel J.U., De Bruyne M., De Rycke R., Geelen D., Willats W.G.T., Vanholme B., and Boerjan W., 2019, Polyploidy affects plant growth and alters cell wall composition, Plant Physiol., 179(1): 74-87.
[3] Gao G., Chen P., Chen J.K., Chen K.M., Wang X.F., Abubakar A.S., Liu N., Yu C.M., and Zhu A.G., 2019, Genomic survey, transcriptome, and metabolome analysis of Apocynum venetum and Apocynum hendersonii to reveal major flavonoid biosynthesis pathways, Metabolites, 9(12): 296.
[4] Huang X.Y., Qiu X.J., Wang Y., Abubakar A.S., Chen P., Chen J.K., Chen K.M., Yu C.M., Wang X.F., Gao G., and Zhu A.G., 2023, Genome-wide investigation of the NAC transcription factor family in Apocynum venetum revealed their synergistic roles in abiotic stress response and trehalose metabolism, Int. J. Mol. Sci., 24(5): 4578.
[5] Jiang L., Zhang L., and Tian C.Y., 2018, Research progress of Apocynum venetum resources and its conservation and development utilization, Jiangsu Nongye Kexue (Jiangsu Agricultural Sciences), 46(18): 9-13.(姜黎,张垒,田长彦,2018,罗布麻资源研究进展及其保育与开发利用,江苏农业科学,46(18):9-13.)
[6] Jiang L., Wu X.J., Zhao Z.Y., Zhang K., Tanveer M., Wang L., Huang J.F., Tian C.Y., and Wang L., 2021, Luobuma (Apocynum) – cash crops for saline lands, Ind. Crop. Prod., 173: 114146.
[7] Li J.J., Deng W., Xu Z.N., Zhang Z.J., and Lu B.S., 2022, Induction and identification of polyploid from Pistacia chinensis, Dongbei Linye Dxue Xuebao (Journal of Northeast Forestry University), 50(10): 18-22.(李娟娟,邓伟,许泽楠,张子君,路丙社,2022,黄连木多倍体诱导及鉴定,东北林业大学学报,50(10):18-22.)
[8] Li T., Feng R.Q., Zhang Z.X., Zhao Y.F., Lan Y.R., Malik K., Wang L., Liu L., White J., and Li C.J., 2023a, Balancing quality and productivity of Apocynum venetum with N and P fertilizer management under drip irrigation in arid conditions of Northwest China, Ind. Crop. Prod., 201: 116884.
[9] Li X., Li J.J., Su H.Y., Sun P., Zhang Z., Li M.F., and Xing H., 2023b, Physiological and transcriptional responses of Apocynum venetum to salt stress at the seed germination stage, Int. J. Mol. Sci., 24(4): 3623.
[10] Liu D., Wang S.Y., Wang G.N., Zheng L.H., Sun Y., Liu L., and Bao Y.L., 2022, Structural characterization and immunoregulatory activity of a neutral polysaccharide from the roots of Apocynum venetum L, Int. J. Biol. Macromol., 222(Pt A): 90-100.
[11] Madani H., Escrich A., Hosseini B., Sanchez-Muoz R., Khojasteh A., and Palazon J., 2021, Effect of polyploidy induction on natural metabolite production in medicinal plants, Biomolecules, 11(6): 899.
[12] Wei Z., Zhang X.A., Zhang Y., Liu X.Z., Ye Q.X., Li Y.P., and Zhang H.Y., 2020, Polyploid induction and identification of yellow-flesh Actinidia chinensis, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 18(12): 4036-4040.(魏卓,张先昂,张越,刘小珍,叶琴霞,李贻沛,张汉尧,2020,黄心中华猕猴桃多倍体诱导及鉴定,分子植物育种,18(12):4036-4040.)
[13] Wu Z.H., Niu B.T., and Wang X.Y., 2005, Research progresses in chromosome doublings of medicinal plants, Xibei Zhiwu Xuebao (Acta Botanica Boreali-Occidentalia Sinica), (12): 2569-2574.(武振华,牛炳韬,王新宇,2005,药用植物染色体加倍的研究进展,西北植物学报,(12):2569-2574.)
[14] Xu Z.G., Zhu C.C., Zhou J.Y., Zhao Z.X., Li Y., Zhang J., Zhou Y., and Zhang L., 2021, Mechanism exploration of Apocynum venetum L. leaves in treatment of hyperlipidemia based on network pharmacology and molecular docking, Zhongyao Xinyao yu Lingchuang Yaoli (Traditional Chinese Drug Research and Clinical Pharmacology), 32(8): 1154-1163.(许泽恭,祝晨蔯,周玖瑶,赵钟祥,李瑜,章娟,周园,张蕾,2021,基于网络药理学和分子对接探究罗布麻叶抗高脂血症的作用机制,中药新药与临床药理,32(8):1154-1163.)
[15] Zhang G.N., Guo C.Q., Zhang X.L., and Tian J., 2021, Induction and identification of polyploid in ‘Ledu Purple Garlic’, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 19(17): 5768-5774.(张广楠,郭春倩,张祥林,田洁,2021,‘乐都紫皮大蒜’多倍体的诱导与鉴定,分子植物育种,19(17):5768-5774.)
[16] Zhang H., Long H.Z., Lu G.D., and Chen R., 2017, Inducement and identification of polyploids in Lycium ruthenicum Murr., Henongxue Bao (Journal of Nuclear Agricultural Sciences), 31(1): 59-65. (张虹, 龙宏周, 路国栋, 陈任, 2017,黑果枸杞多倍体诱导及鉴定,核农学报,31(1):59-65.)
文章摘自:王悦,黄晓钰,陈平,陈继康,陈坤梅,陈佳,高钢,朱爱国.罗布红麻多倍体诱导条件优化及生物学特征变化分析[J/OL].分子植物育种.