摘 要:为探究火麻干旱胁迫的耐受能力及复水后其次生代谢产物的含量变化。土培盆栽的方式培养火麻幼苗,以正常浇水的火麻为对照(CK),对比分析胁迫组在胁迫后的0、3、5、7、9d和复水后的生理特性、光合及次生代谢产物的变化情况。结果表明:干旱胁迫条件下,火麻叶中含水量、光合指标、最大光能转换效率、实际光能转换效率、ETR、qP降低;而NPQ、叶绿素和类胡萝卜素、脯氨酸、可溶性蛋白、可溶性糖及MDA含量和相对电导率上升,4种抗氧化酶活性升高,复水后叶片含水量、叶绿素b、光合指标、脯氨酸含量和SOD活性低于CK组,其他各生理指标均高于CK组水平。总黄酮、总酚和总萜含量升高,复水后这3种次生代谢产物含量不同程度地低于对照。火麻的第1、2对叶片中CBD含量随胁迫程度的增加而降低,且远高于下部叶片;第3、4对叶中CBD含量虽在7d胁迫处理时含量最高,但仍低于对照并且二者差异不显著(P<0.05);第5、6对叶片在胁迫处理的3d时CBD含量达到峰值。复水后,3组叶位中的CBD含量均高于CK组。综合研究发现,适度的干旱胁迫会提高火麻的生理抗逆性,降低其光合作用,提高次生代谢产物的含量。胁迫会降低药物活性物质CBD的含量;在适度的胁迫经复水后,缓解了胁迫对植物的伤害,并提高叶片中CBD的含量。
关键词:火麻;干旱胁迫;水分胁迫;生理特性;光合特性;次生代谢产物;大麻二酚;亏水灌溉
在人类的活动干预以及全球气候变暖的影响下,干旱问题日益严峻,干旱胁迫是对植物危害较大的非生物胁迫重要因素之一,使植物的生长发育、生理生化、生物量、产量和品质受到影响,制约了农业生产的发展。现阶段,研究者们在对植物的抗旱机制以及耐旱研究等方面进行深度的探究,通过直接或者间接的手段提高了植物的抗旱性,并利用多种培育方式提高土地利用率,对植物的生产量以及药用活性物质含量的提高有着非常重要的意义。受到胁迫损伤的植株可以用复水的方式缓解可逆转损伤,例如,吕海燕等研究发现受到短期干旱胁迫的两种石斛属植物经复水后,其光合作用均恢复到充分供水时的水平,而受到长期或严重的胁迫会对其造成无法逆转的伤害。刘乔斐等研究结果发现干旱胁迫下的北柴胡复水后生理损伤得到恢复,补偿效应的出现促进了次生代谢产物的积累,从而提高了药材的品质。
火麻(Cannabis sativa L.),又称汉麻、工业大麻等,是桑科(Moraceae)大麻属(Cannabis)的一年生直立双子叶草本植物,在自然状态下多为雌雄异体,少数为雌雄同体[8]。火麻具有较高的利用价值,体内含有许多具有药用活性的次生代谢产物,其所特有的单萜集团分子结构的萜酚类次生代谢产物被称为大麻素,大麻二酚(Cannabidiol,CBD)和四氢大麻酚(Tetrahydrocannabinol,THC)是2种重要的大麻素成分。其中的THC导致精神成瘾性,而CBD常常会抑制THC导致的成瘾性。此外,CBD还具有抗炎、抑菌、抗抑郁等多种重要的生物活性功能。火麻的根茎、花叶以及种子,不管是活性物质还是纤维成分,在农业、工业、医疗及保健食品等方面应用广泛,火麻(工业大麻)的种植与加工相关产业也迅速发展。目前,关于干旱胁迫及复水条件下烤烟等植物的研究较多,而对于火麻在干旱胁迫及复水条件下对其生理指标及次生代谢产物含量影响的研究工作相对缺乏。因此,本文以火麻为对象,在预实验的基础上,设置不同干旱时间梯度并选择最适梯度复水,研究在干旱胁迫及复水下火麻生理特性和叶中次生代谢产物含量的变化,从而找出对火麻药用活性物质含量有利的方案,为火麻的高产栽培和次生代谢产物的利用提供科学基础依据,对火麻的高效节水灌溉提供理论依据。
1 材料与方法
1.1 试验材料
火麻种子采自广西巴马镇,于2021年4月初,将其种植于东北林业大学森林生态教育部重点实验室的温室内并进行培育。土壤基质配比为腐殖土:蛭石为2∶1。具体实施方法为:将种子点种在浇透后的基质上,上面覆盖一层2cm的薄土,待植株生长出第3片真叶时,选取长势较好的幼苗将其移植到花盆中,每盆移栽2株,期间进行日常管理,确保火麻苗的营养和水分充足。将基质浸泡24h后检测其含水量,经过多次测定,基质的最大含水量为58.18%。
1.2 试验设计
待生长3个月时,选取长势一致的火麻苗,每20盆为一组,共40盆,以正常浇水的火麻植株作为对照(CK),一组作为对照组继续正常浇水,另一组作为胁迫组停止浇水并进行干旱处理,选取在干旱处理的第0、3、5、7、9d取样并进行各项指标的测定。根据预实验结果确定了火麻胁迫梯度,并发现胁迫组火麻在9d时已不能正常存活,进行复水后,植物易死亡,且各指标不能恢复,所以选取在干旱处理7d后对植株进行复水(fs),浇水量为200mL,此时土壤足够湿润,盆底无水滴溢出,并于复水后的第4d进行取样。为排除其他因素干扰,所有植株于每个时间段的8:00进行取样。其中,鲜样经液氮冷冻后放置于-80℃冰箱中保存,用于各项生理指标测定。从植株顶端自上而下分别选取第1、2对,第3、4对以及第5、6对真叶,置于阴凉干燥处自然晾干,进行次生代谢产物的测定。所有处理均进行3次重复。
1.3 试验方法
1.3.1 生理指标的测定
光合和叶绿素荧光参数的测定:待植株干旱胁迫到相应时间,于取样前进行光合和叶绿素荧光参数的测定。光合指标采用Li-6400XTP型便携式光合仪(美国LI-COR公司)在阳光充足时的8:00-11:00测定净光合速率(Pn)、气孔导度(Gs)及蒸腾速率(Tr)等光合参数,并计算其水分利用效率EWU=Pn/Tr;叶绿素荧光参数利用PAM-2500叶绿素荧光仪(德国WALZ公司)测定。火麻叶片于暗处避光20min后,对其进行初始荧光强度(F0)、最大荧光强度(Fm)、PSII实际光能转化效率(Fm?-Fs/Fm?)、PSII最大光能转化效率(Fv/Fm)以及非光化学淬灭系数(QNP)、光化学淬灭系数(qP)、电子传递速率(RET)的测定。过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)和超氧化物歧化酶(SOD)活性,丙二醛(MDA)含量、脯氨酸含量、可溶性糖含量和可溶性蛋白含量的测定,以及叶绿素a、叶绿素b和类胡萝卜素等光合色素含量测定均采用王学奎等的方法进行测定,叶片相对含水量和相对电导率的测定采用FanS的方法进行。
1.3.2 次生代谢产物含量的测定
罗总黄酮、总酚和总萜的提取采用李娜娜等的方法,总黄酮含量测定采用氯化铝比色法,总酚含量测定采用福林酚法,总萜的含量测定采用香草醛高氯酸显色法。大麻二酚采用超声辅助萃取法提取和高效液相色谱法进行含量测定。
1.4 数据分析
各项指标的测定重复3次,原始数据记录及统计使用MicrosoftExcel2019进行;采用SPSS21.0软件对实验数据进行方差分析,并使用Origin2018进行绘图。
2 结果与分析
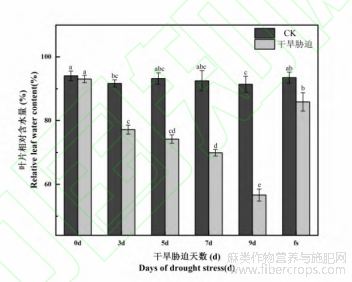
2.1 干旱胁迫对火麻叶片相对含水量的影响
植物细胞在受干旱胁迫后会发生失水,叶片相对含水量能够反应出植物细胞水分的多少,并在一定程度上反应植物受干旱胁迫的状况。由图1可以看出,在干旱胁迫0d时,叶片相对含水量在93%左右,随着胁迫天数的延长,火麻叶片的相对含水量呈逐渐降低的趋势,干旱胁迫末期(9d)相对于0d的相对含水量减少了36.39%,复水后植物叶片的相对含水量为85.88%,仍低于对照,但差异不显著(P>0.05)。
图1 干旱胁迫对火麻叶片相对含水量的影响
注:除特殊注明,相同的小写字母表示CK组或胁迫组内间显著不差异(P>0.05),不同的小写字母表示CK组或胁迫组内间显著差异(P<0.05),下同。
2.2 干旱胁迫对火麻叶片光合和叶绿素荧光的影响
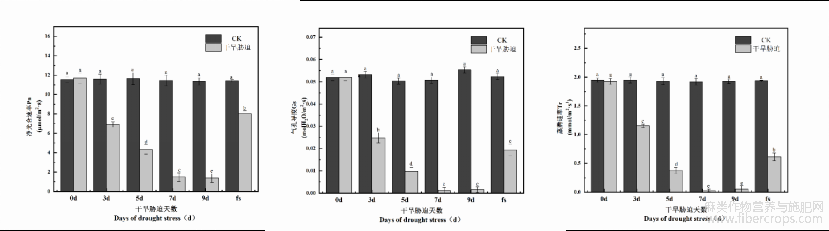
2.2.1 干旱胁迫对火麻叶片光合指标的影响
由图2可知,不同干旱胁迫处理的大麻苗其光响应曲线表现出一定的差异性。不管是净光合速率、气孔导度,还是蒸腾速率都随着干旱时间的延长而呈现降低趋势,尽管气孔导度和蒸腾速率在处理的9d比7d时有所上升,但差异不显著(P>0.05)。复水后,净光合速率、气孔导度和蒸腾速率的值有所提高,但仍低于CK,并且差异显著(P<0.05)。
图2 干旱胁迫对火麻叶片光合指标的影响
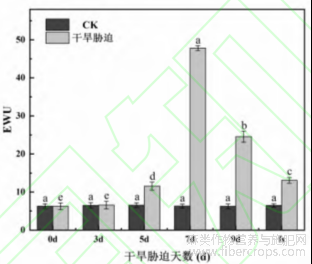
由图3可知,在干旱胁迫下火麻的水分利用效率呈现先上升再下降的趋势,在干旱胁迫7d时达到最高,是CK的7.64倍。复水后水分利用效率较干旱处理时的7d和9d低,但高于CK组,为CK组的2.08倍,这说明干旱后复水可提高火麻的水分利用效率从而增加消耗单位水产生干物质的量。
图3 干旱胁迫对火麻叶片水分利用效率的影响
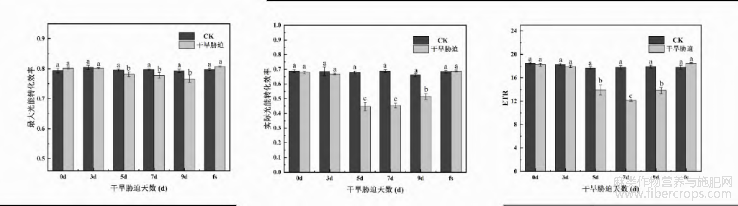
2.2.2 干旱胁迫对火麻叶片叶绿素荧光指标的影响
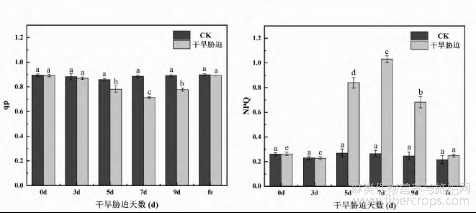
自然干旱胁迫下对火麻叶绿素荧光参数的影响如图4所示,可以看出,干旱处理后,在胁迫处理5d、7d、9d这3个时间段,PSII系统的最大光能转化效率、实际光能转化效率、ETR均减少,胁迫处理0d、3d和复水组无显著差异。这说明了自然干旱胁迫对火麻叶片的叶绿素荧光结构产生负效应,随着自然干旱胁迫天数的增加,植物的PSII光化学效率降低,电子传递量子效率受到抑制,在胁迫5d、7d、9d时,非光化学淬灭系数NPQ显著升高,光化学淬灭系数qP显著减少,并在7d时达到最高值,为CK组的3.93倍,整体呈先升高后降低的趋势。复水后,干旱胁迫对火麻荧光结构的损害得到缓解,稳态光化学效率恢复,火麻叶绿素荧光参数除qP稍低于对照,差异不显著(P>0.05)外,其他各指标均高于对照,但差异不显著(P>0.05)。
图4 干旱胁迫对火麻的叶绿素荧光影响
2.2.3 干旱胁迫对火麻光合色素含量的影响
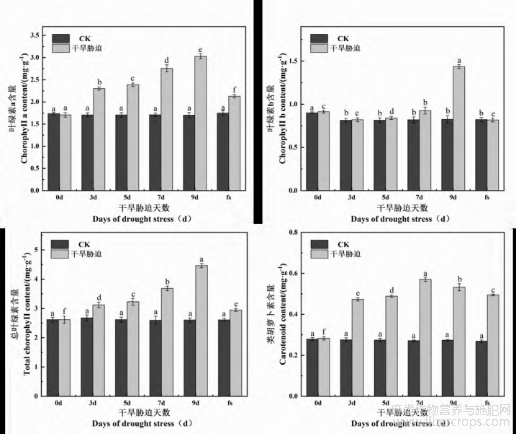
干旱胁迫对火麻光合色素含量的影响如图5所示。叶绿素a与总叶绿素含量变化趋势一致,都是随着干旱胁迫天数延长而逐渐增大,在9d时含量达到最高,与CK相比差异显著(P<0.05)。而叶绿素b含量随胁迫时间呈现先降低后升高的趋势,在9d时含量达到最高。类胡萝卜素含量随干旱胁迫天数的增加则出现先升高再降低的趋势,在7d达到最高,然后降低,但仍远高于CK且差异显著(P<0.05)。复水后,各相关色素的含量较胁迫末期低,达到差异显著水平(P<0.05),与CK相比,除叶绿素b含量稍低于CK(P<0.05)外,其他色素含量均高于CK且差异显著(P<0.05)。
图5 干旱胁迫对火麻叶片光合色素的影响
2.3 干旱胁迫对火麻叶片渗透调节物质的影响
植物体内的渗透调节物质往往会在遭受逆境的伤害后发生响应,调节渗透调节物质的含量从而缓解胁迫对植物的损害。由图6可知,随干旱胁迫天数的延长,可溶性蛋白和脯氨酸含量呈现逐渐升高的趋势,并均在9d时达到最高。而可溶性糖含量出现先升高后降低的趋势,并在胁迫处理7d时出现峰值。复水后,3种渗透调节物质均较胁迫末期含量低,且差异显著(P<0.05);与CK相比,复水后的可溶性蛋白和可溶性糖含量均高于CK,并且差异显著下降(P<0.05),而脯氨酸含量较CK低,但差异不显著(P>0.05)。
图6 干旱胁迫对火麻中渗透调节物质的影响
2.4 干旱胁迫对火麻叶片抗氧化酶活性的影响
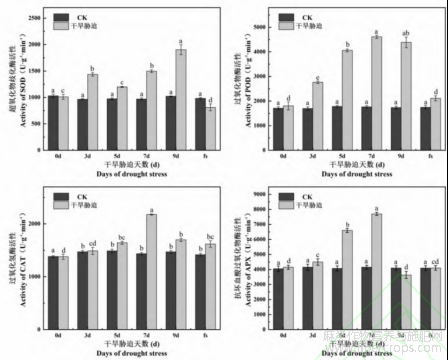
干旱胁迫对火麻抗氧化酶活性的影响如图7所示。由图7可以看出,一定程度的干旱胁迫会提高火麻体内抗氧化酶的活性。随干旱胁迫天数的增加,SOD活性呈“S”形上升趋势,在3d和9d出现2个峰值,且后者高于前者,差异显著(P<0.05)。POD、CAT和APX3种抗氧化酶活性随胁迫时间延长先升高后降低,且均在7d时活性最高。除了APX酶活性在处理末期低于CK外,POD、CAT两种酶的活性均高于CK。复水后,除APX酶活性高于胁迫处理末期外,其他3种抗氧化酶活性均低于胁迫处理末期,且差异显著(P<0.05)。与CK相比,除了SOD酶活性低于CK,但差异不显著(P>0.05),而POD、CAT和APX三种酶活性复水后高于CK。
图7 干旱胁迫对火麻叶片抗氧化酶的影响
2.5 干旱胁迫对火麻叶片细胞膜指标的影响
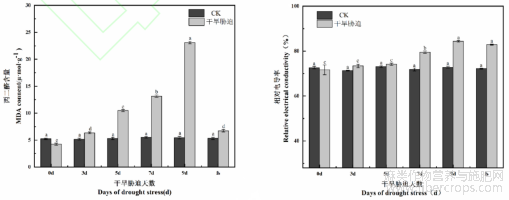
植物受到逆境胁迫时会导致细胞膜受到损害,使其产生因活性氧引发的膜脂过氧化现象和细胞膜相对透性发生改变。丙二醛(MDA)的相对含量和相对电导率可以反映出膜脂过氧化情况细胞膜相对透性。由图8可知,MDA含量和相对电导率随着干旱胁迫天数的不断延长呈逐渐升高的趋势,胁迫末期(9d)含量最高。复水后,二者均低于胁迫末期值,MDA呈现差异极显著(P<0.01),相对电导率则差异不显著(P>0.05);与CK相比,复水后的MDA含量和相对电导率均高于CK,且差异显著(P<0.05)。
图8 干旱胁迫对火麻叶片MDA及相对电导率的影响
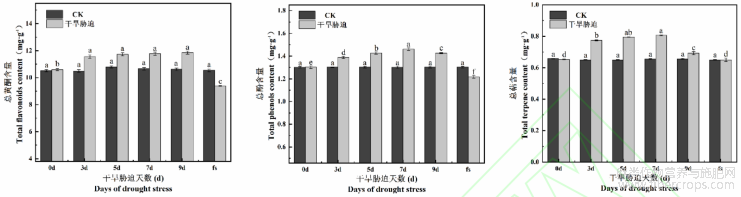
2.6 干旱胁迫对火麻叶片次Th代谢产物的影响
从图9可知,胁迫下的火麻中总黄酮含量均高于CK,随干旱胁迫天数的延长总黄酮含量逐渐呈增加趋势,除0d外,其余胁迫时间总黄酮含量差异不显著(P>0.05)。而总酚和总萜含量随胁迫时间先升高而后降低,但处理末期(9d)二者含量仍高于CK,且差异显著(P<0.05)。复水后,3种次生代谢产物呈现不同程度的降低,并低于CK。总黄酮含量与CK相比,差异显著(P<0.05),而总酚和总萜含量则表现出差异不显著(P>0.05)。
图9 干旱胁迫对火麻叶片总黄酮、总酚、总萜含量的影响
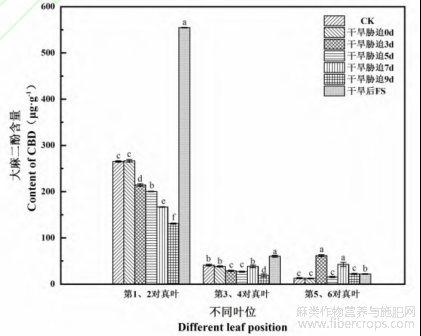
第1、2对火麻叶中大麻二酚(CBD)含量随干旱处理时间而逐渐降低;第3、4对叶中CBD含量随处理时间呈现“S”形变化,但都低于CK;第5、6对叶中CBD的含量在处理的3d和7d时含量高于CK,且呈现显著性差异(P<0.05),其余处理时间虽高于CK,但差异不显著(P>0.05)。复水后,第1、2对和第3、4对叶中CBD显著高于CK和各处理,第1、2对叶中CBD含量是CK的2.09倍,第3、4对中CBD含量是CK的1.47倍。复水后第5、6对叶中CBD的含量虽为CK的1.70倍,但仍低于胁迫处理中最大值,并且差异极显著(P<0.01)(图10)。
图10 干旱胁迫对火麻不同叶位叶片CBD含量的影响
3 讨论
3.1 干旱胁迫对火麻叶片渗透调节物质的影响
土壤中水分的多少是影响植物生理生化指标变化的重要原因之一,植物的生长离不开水分的参与,土壤水分直接反应植物的生长环境的状态。在植物受到干旱胁迫时,净光合速率Pn、蒸腾速率Tr、气孔导度Gs等光合生理指标值均会受到明显的影响,不同植物其下降的响应程度是完全不同的。水分利用效率EWU是植物在受光合以及蒸腾作用等因素的影响下消耗的一定单位的含水量生成的干物质的量,在特定时期经过适度的干旱胁迫处理后再复水,利用补偿机制提高农作物产量,利用旱后补偿效应是提高植物的EWU的非常理想的手段。根据张飞等的研究发现,干旱胁迫使夹竹桃植株的Pn、Tr、EWU显著降低,复水后这3种指标都出现不同程度地增加,夹竹桃也可以很快恢复。在本研究中,干旱胁迫显著降低了胁迫组中火麻的净光合速率、蒸腾速率和气孔导度,而水分利用效率不断增加,此时火麻能合成的干物质量也随之增多,复水处理后EWU下降到与胁迫第五天相近,胁迫组的Pn逐渐恢复并趋近于正常植株的状态,而Tr、Gs恢复相对较慢,这说明火麻经复水后出现滞后效应,受胁迫后的植株伤害较大且尚未完全恢复,这与李佳佳等对西红柿的研究结果相一致。
叶绿素荧光是通过反应光能吸收、光化学反应等过程,利用荧光成像等多种手段作为探针去探究光合作用与外界环境的机理的一种简单、便捷的方法。根据之前人们研究结果得知,随着干旱胁迫程度的加深,植物叶片水势随之降低,光合作用受限制因素由气孔因素向非气孔因素转变,如磷酸烯醇丙酮酸羧化酶(PEP)和RuBisCo活力的下降,叶绿体的希尔反应减弱、RuBP再生受限制等因素。在本研究中,相比于正常植株,干旱胁迫使火麻叶片的最大光能转化效率、实际光能转化效率、ETR、qP下降,NPQ升高。这一实验结果说明了,随着干旱胁迫天数的增加,叶片光合作用在一定程度上被抑制,光系统II(PSII)反应中心受到影响,促使光保护能力提高。火麻将过剩的光能转化为热耗散的能量,光系统多分配于非光化学淬灭方向进而使植物得到保护,这与庄晔对烟草的研究结果一致。
叶绿素是植物光合器官的重要组成部分,它可以帮助植物吸收、采集和传递生长所需的光能。植物的健康以及营养状况可以通过植物叶片颜色表征,其中叶绿素是主要的色素成分,在评价植物受胁迫程度方面有一定的作用。有学者认为干旱胁迫会导致植物叶绿素及其前体物质含量变化,最后造成叶绿素含量下降,也有学者认为,干旱抗性强的植株叶绿素呈上升趋势且上升幅度大。在本研究中,随着干旱胁迫天数的延长,叶片中叶绿素a、叶绿素b、总叶绿素含量随之增加。其中叶绿素b响应稍慢一些,类胡萝卜素含量呈先升高后降低的趋势,经复水后其含量均下降。这一结果表明火麻具有一定的抗旱性,短期的干旱胁迫会使火麻的叶绿素含量升高,叶绿素a比叶绿素b的合成速度要快,类胡萝卜素含量会先有下降趋势。经复水后,叶绿素b含量下降最为明显,结果已与未胁迫相近,其次是叶绿素a含量;类胡萝卜素含量下降幅度最小,比起叶绿素响应稍慢。
3.2 干旱胁迫对火麻叶片渗透调节物质的影响
渗透调节物质可以作为植物在受到干旱胁迫时的重要观测指标,植物通过控制细胞的渗透调节,维持内外渗透平衡和细胞膨压来缓解胁迫造成的伤害。此外,植物叶片形态特征发生变化也会引起生理指标发生变化,促使二者共同抵御胁迫。本研究中,在干旱胁迫的条件下,火麻叶片中的脯氨酸、可溶性蛋白含量上升,可溶性糖含量先上升后下降,这说明火麻叶片为了抵御干旱胁迫的伤害会将可溶性糖、可溶性蛋白及脯氨酸大量积累,在胁迫加重后,可溶性糖率先产生了响应。复水后脯氨酸降到对照组的水平,可溶性糖和可溶性蛋白含量下降非常显著,对复水的响应也比较明显。这些现象说明,随着干旱胁迫天数的延长,为了维持渗透势,火麻体内渗透调节物质含量呈现逐渐升高的趋势,经复水后渗透调节物质含量下降,趋近于正常植株,复水会使胁迫组火麻的渗透调节物质的含量趋近于正常,防止渗透调节物质含量过高对植物造成损害。
3.3 干旱胁迫对火麻叶片抗氧化酶的影响
在逆境胁迫的条件下植物体内会积累大量活性氧(ROS),产生氧自由基等对自身有害的物质。SOD、POD、CAT以及APX是植物体内抗氧化系统中非常关键的保护酶,用以清除过多的自由基,起到维持植物体内平衡,防止活性氧浓度超出自身清除的能力范围之外的作用。在本试验中,在干旱胁迫的环境下,随着干旱天数的延长,胁迫组植株中的SOD、POD、CAT及APX的活力都呈现出先升高后减少的趋势。这一结果表明,随着干旱程度的增加,植物体内的抗氧化酶系统开始响应,在一定胁迫程度内,火麻叶片产生抗氧化酶来清除产生的有害物质,当胁迫超过一定程度后,超过了体内抗氧化酶系统的清除能力,多余活性氧自由基无法有效清除,导致酶活性显著降低。抗坏血酸过氧化物酶功能下降,要弱于未受胁迫的火麻植株。经复水后,火麻体内的SOD、POD、CAT、APX活性下降,且APX对干旱胁迫的响应早于POD,胁迫造成的损害得到缓解,这与庄晔对烤烟的研究结果一致。
3.4 干旱胁迫对火麻叶片细胞膜的影响
植物在逆境中,体内细胞膜的功能和结构首先受到损害,使得细胞膜相对透性增大,故细胞内的物质更多流失于细胞间隙中,导致细胞外的电解质增多。因此,相对电导率的变化可反映细胞膜的相对透性,从而看出细胞膜的伤害情况。细胞膜中脂类是非常重要的组成成分,在干旱胁迫下,膜脂过氧化程度的加深是由于植物体内活性氧自由基等有害物质的累积引起的,使细胞膜结构完整性也遭到破坏。MDA作为植物体膜脂过氧化途径中的重要产物之一,可通过其含量的变化对膜脂过氧化程度进行监测。在本试验中,随着干旱胁迫天数的延长,丙二醛含量和相对电导率呈上升趋势,随胁迫程度的增加上升幅度也更明显,这说明火麻叶片有一定的抗旱性。但随着胁迫程度的增加,相对电导率显著上升,细胞外渗液含量变多,细胞膜相对透性增加,植物体内产生MDA的积累量显著增加,膜脂过氧化程度加深导致对细胞膜的损伤程度增大。经复水后,MDA含量降低,胁迫对细胞膜的伤害得到缓解,相对电导率下降不显著,细胞膜相对透性未发生变化,此时植物受害并未恢复完全。这与刘江等对大豆的研究结果一致。
3.5 干旱胁迫对火麻叶片次Th代谢产物的影响
在植物遭受胁迫时,活性氧自由基在植物体内积累,黄酮具有比较强的抗氧化性,植物内部会引发黄酮合成的响应来增强对胁迫的抗性。屠玲艳等对水分胁迫的三叶青进行研究发现,适度的水分胁迫会使三叶青体内黄酮合成途径关键酶活性升高从而提高黄酮含量,进而提高抗性。酚类物质同样具有抗氧化作用,在植物遭受胁迫伤害时,会使其含量增加,以对抗活性氧带来的伤害。干旱胁迫也会使萜类物质积累,特别是倍半萜的合成从而调控植物对干旱胁迫的响应,增强抗旱性。在本研究中,受到干旱胁迫后,火麻中的总黄酮含量呈显著上升趋势,总酚含量与总萜含量呈先升高后降低的趋势,但均高于CK组。经复水后,总黄酮、总萜和总萜含量均低于CK组。这些结果表明,在一定干旱胁迫范围内,胁迫会使火麻总黄酮、总酚、总萜含量升高,用来减少活性氧对植物的伤害,从而提高对干旱胁迫的抗性。反之,在超过植物所承受的限度后,次生代谢物质的含量呈下降趋势。复水后,由于环境发生变化,植物优先进行营养生长以保证生理活动能够正常进行,而进行次生代谢变为次要。CBD作为火麻中重要的次生代谢产物,主要在火麻植物的腺毛中产生合成和积累。本研究中正常生长的火麻叶中CBD的含量在植株最顶端的幼嫩部位的叶片中含量最高,是下面部位叶片CBD含量的5~10倍,甚至更多。植物的幼嫩部位最易于遭受到植食性小动物和昆虫等的侵害,有研究表明,在植株幼嫩部位次生代谢产物被大量合成用来提供防御功能和调节防御信号通路,以保护植物免受侵害。在受到干旱胁迫后,尽管火麻最顶端的第1、2对叶中的CBD含量随着胁迫时间逐渐降低,但仍远高于其下部的第3、4对和第5、6对叶中的CBD含量。有研究表明,CBD也具有一定的抗氧化能力,能够有效缓解氧化损伤。而第5、6对叶在胁迫过程整体CBD含量高于对照,可能相对成熟叶片对胁迫的伤害有相对滞后效应。复水后3组叶中的CBD的含量不同程度的高于CK,复水可使胁迫对植物的伤害得到缓解,植株较快响应来恢复其利用次生代谢产物发挥防御功能,CBD可能参与胁迫后修复的作用,以及胁迫过程的氧自由基的清除来降低对脂膜的破坏,为以后这方面的研究提供了思路。
4 结论
本实验通过不同的自然失水天数及复水对火麻的生理特性及次生代谢产物含量变化进行综合分析,得出下列结论:
(1)随着胁迫天数的增加,干旱胁迫对火麻的细胞膜损害程度增加,光合作用抑制明显,光合色素含量增加,叶片含水量持续降低,4种抗氧化酶活性升高,其中SOD、POD、APX酶活性均在7d时达到最高,随后下降,经复水后恢复正常水平,适度的干旱胁迫能使火麻抗氧化酶活性提高。
(2)随着干旱胁迫天数的增加,WUE呈先升高后降低,火麻体内总黄酮、总酚、总萜含量会明显提高,用以减少活性氧对植物的损伤,而CBD含量降低,经选取特定天数进行复水后,总黄酮、总酚、总萜含量趋于正常,3组叶位CBD含量均高于CK,适度的胁迫一定时间再复水,胁迫对植物的损伤得到缓解,并且有利于CBD的合成与积累。三组不同叶位中的CBD含量中,火麻中越幼嫩的部位叶片,CBD含量越高,这为火麻叶片这一可再生资源的开发利用提供了数据支撑。
参考文献
[1] GILL A R, LOVEYS B R, COWLEY J M, et al. Physiological and morphlogical responses of industrial hemp (Cannabis sativa L.) to water deficit. Industrial Crops and Products, 2022, 187: 115331.
[2] 李彦彬,边泽鹏,李道西,等.花前干旱复水对冬小麦光合特性、产量和水分利用效率的影响.中国农村水利水电,2020,452(6): 130-134, 138.LI Y B, BIAN Z P, LI D X, et al. Effects of anthesis drought and rehydration on photosynthetic characteristics, yield and water use efficiency of winter wheat. China Rural Water and Hydropower, 2020(6): 130-134, 138.
[3] 李其勇,朱从桦,李星月,等.水稻川香29B近等基因导入系苗期根系形态、叶片生理生化特性与抗旱性的关系.干旱地区农业研究, 2022, 40(4): 238-248.LI Q Y, ZHU C H, LI X Y, et al. Relationship between root morphology, physiological and biochemical characteristics of leaves and drought resistance of Chuanxiang 29B near-isogenic introgression lines at seedling stage. Agricultural Research in the Arid Areas, 2022, 40(4): 238-248.
[4] 孙天国,张梅娟,马天意,等.外源亚精胺对干旱胁迫下甜瓜幼苗抗旱性影响的生理生化机制.北方园艺, 2022(12): 34-39.SUN T G, ZHANG M J, MA T Y, et al. Physiological and biochemical mechanism of exogenous spermidine improving drought resistance in melon seedlings under drought stress. Northern Horticulture, 2022(12): 34-39.
[5] 赵越,张晓艳,曹焜,等.工业大麻抗逆生理及分子机制研究进展.中国农学通报, 2022, 38(6): 102-106.ZHAO Y, ZHANG X Y, CAO K, et al. Physiology and molecular mechanism of stress resistance in hemp: a review. Chinese Agricultural Science Bulletin, 2022, 38(6): 102-106.
[6] 吕朝燕,高智席,邓富梅,等.两种石斛属植物光合特性对干旱胁迫及复水的响应.节水灌溉, 2023(2): 111-120, 127.LÜ C Y, GAO Z X, DENG F M, et al. Responses of photosynthetic characteristics of two dendrobium plants to drought stress and rewatering . Water Saving Irrigation, 2023(2): 111-120, 127.
[7] 刘乔斐.干旱胁迫与复水对北柴胡生长和根部次生代谢物含量的影响.上海农业学报,2022, 38(3): 42-47.LIU Q F. Effects of drought stress and re-watering on the growth and the secondary metabolites content in the roots of Bupleurum chinense . Acta Agriculturae Shanghai, 2022, 38(3): 42-47.
[8] 孙 哲,王金娥,乔永刚.工业大麻发育早期雌雄株鉴定方法的研究.农业与技术,2021,41(14):20-24.SUN Z, WANG J E, QIAO Y G. Study on identification method of male and female plant in early development of industrial hemp. Agriculture and Technology, 2021, 41(14): 20-24.
[9] MORGAN C J A, FREEMAN T P, HINDOCHA C, et al. Individual and combined effects of acute delta-9-tetrahydrocannabinol and cannabidiol on psychotomimetic symptoms and memory function. Translational Psychiatry, 2018, 8: 181.
[10] LI H, LIU Y, TIAN D, et al. Overview of cannabidiol (CBD) and its analogues: structures, biological activities, and neuroprotective mechanisms in epilepsy and Alzheimer’s disease. European Journal of Medicinal Chemistry. 2020, 192: 112 163.
[11] KONGKADEE K, WISUITIPROT W, INGKANINAN K, et al. Anti-inflammation and gingival wound healing activities of Cannabis sativa L. subsp. sativa (hemp) extract and cannabidiol: An in vitro study. Archives of Oral Biology. 2022, 140:105 464.
[12] TANG K, WANG J, YANG Y, et al. Fiber hemp (Cannabis sativa L.) yield and its response to fertilization and planting density in China. Industrial Crops and Products. 2022, 177: 114 542.
[13] 王学奎,黄见良.植物生理生化实验原理与技术.3版.北京:高等教育出版,2015.WANG X K, HUANG J L. Principles and techniques of plant physiological biochemical experiment. Beijing: Higher Education Press, 2015.
[14] FAN S, WU H, GONG H, et al. The salicylic acid mediates selenium-induced tolerance to drought stress in tomato plants. Scientia Horticulturae. 2022; 300:111 092.
[15] 李娜娜,刘同歌,黄志慧,等.草本资源植物菥蓂对盐胁迫下生理生态及次生代谢产物响应.草业学报, 2022, 31(11): 181-190.
LI N N, LIU T G, HUANG Z H, et al. Physiological ecological and secondary metabolic responses of the herbaceous resource plant Thlaspi arvense to salt stress. Acta Prataculturae Sinica, 2022, 31(11): 181-190.
[16] 付立忠,赵利梅,刘 骞,等.氮素形态对三叶青块根主要化学成分含量及抗氧化活性的影响.中国药学杂志, 2021, 56(8): 633-639.FU L Z, ZHAO L M, LIU Q, et al. Effects of nitrogen forms on main phytochemical content and antioxidant activity in root tubers of Tetrastigma hemsleyanum. Chinese Pharmaceutical Journal, 2021, 56(8): 633-639.
[17] TRUONG D H, TA N T A, PHAM, T V et al. Effects of solvent-solvent fractionation on the total terpenoid content and in vitro anti-inflammatory activity of Serevenia buxifolia bark extract. Food Science & Nutrition, 2021, 9(3): 1 720-1 735.
[18] AGARWAL C, MÁTHÉK, HOFMANN T, et al. Ultrasound?assisted extraction of cannabinoids from Cannabis sativa L. optimized by response surface methodology. Journal of Food Sciences, 2018, 83(13): 700?710.
[19] 朱孟一,傅松玲,孟 然,等.青桐幼苗对水分胁迫的生长及生理响应.安徽农业大学学报, 2021, 48(6): 883-888. ZHU M Y, FU S L, MENG R, et al. Growth and photosynthetic characteristics of the seedlings of Firmiana platanifolia under water stress. Journal of Anhui Agricultural University, 2021, 48(6): 883-888.
[20] 李 斐,孙明伟,钟尚志,等.不同光合类型牧草对干旱-复水的光合生理响应及生长适应策略.植物生态学报, 2022, 46(1): 74-87.LI F, SUN M W, ZHONG S Z, et al. Photosynthetic physiology and growth adaptation of herbages with different photosynthetic pathways in response to drought-rehydration. Chinese Journal of Plant Ecology, 2022, 46(1): 74-87.
[21] 张俊杰,陈金平,汤钰镂,等.花期前后干旱胁迫对复水后夏玉米光合特性与产量的影响.作物学报, 2023, 1-16.ZHANG J J, CHEN J P, TANG Y L, et al. Effects of drought stress before and after anthesis on photosynthetic characteristics and yield of summer maize after re-watering. Acta Agronomica Sinica, 2023, 1-16.
[22] 张 飞,陈慧英,陈 珊,等.干旱胁迫对夹竹桃光合特性的影响.林业科技,2022,47(5): 18-22.ZHANG F, CHEN H Y, CHEN S, et al. Effects of drought stress on photosynthetic characteristics of Nerium indicum. Forestry Science & Technology, 2022, 47(5): 18-22.
[23] 李佳佳,孔珂,王书吉,等.干旱-复水对西红柿光合叶绿素荧光及水分利用效率的影响.中国农村水利水电, 2021(8): 145-150.LI J J, KONG K, WANG S J, et al. Effects of drought-rewatering on photosynthetic chlorophyll fluorescence and water use efficiency of tomatoes. China Rural Water and Hydropower, 2021(8): 145-150.
[24] 丁思佳,程模香,谢双全,等.短命植物生长特性及叶绿素荧光特性对不同土壤类型的响应.草地学报, 2022, 30(12): 3308-3316.DING S J, CHENG M X, XIE S Q, et al. Response of growth characteristics and chlorophyll fluorescence characteristics of ephemeral plants to different soil types. Acta Agrestia Sinica, 2022, 30(12): 3308-3316.
[25] CARVALHO L B, ALVES P L, ANDRADE T C. Content and fluorescence of chlorophyll in eucalypt exposed to glyphosate. Communications in Plant Sciences, 2016, 6(1-2): 7-11.
[26] 庄 晔,葛嘉雪,汪孝国,等.干旱胁迫后复水对烤烟生长及其生理特性的影响.中国烟草学报, 2022, 28(4): 48-58.ZHUANG Y, GE J X, WANG X G, et al. Effect of rehydration after drought stress on the growth and physiological characteristics of flue-cured tobacco. Acta Tabacaria Sinica, 2022, 28(4): 48-58.
[27] 李丰先,罗 磊,李亚杰,等.基于PCA和隶属函数法分析的马铃薯创新种质抗旱性鉴定与分类.干旱区资源与环境, 2022, 36(11): 141-147.LI F X, LUO L, LI Y J, et al. Identification and classification of drought resistance of potato germplasm based on PCA and membership function analysis. Journal of Arid Land Resources and Environment, 2022, 36(11): 141-147.
[28] 张平,张慧,刘俊娜,等.干旱及复水处理对抗旱性不同小麦品种/系苗期生理生化指标的影响.西北农业学报, 2020, 29(12): 1795-1 802.ZHANG P, ZHANG H, LIU J N, et al. Effects of drought and re-watering treatment on physiological and biochemical indexes of different drought-resistant wheat varieties/lines at seedling stage. Acta Agriculturae Boreali-occidentalis Sinica, 2020, 29(12): 1 795-1 802.
[29] 王 鹏,杨奥军,冯志进,等.外源5-ALA对干旱胁迫下玉米幼苗生长的缓解效应及抗氧化酶基因表达的影响.干旱地区农业研究, 2022, 40(4): 1-9.WANG P, YANG A J, FENG Z J, et al. Effects of exogenous 5-ALA on growth of maize seedlings and expression of antioxidant enzyme genes under drought stress. Agricultural Research in the Arid Areas, 2022, 40(4): 1-9.
[30] 王 爽,吕 霞.外源ABA对干旱胁迫及复水下弥勒苣苔生长的影响.黑龙江农业科学, 2022 (6): 67-71.WANG S, LYU X. Effects of exogenous ABA on Paraisometrum millense growth under drought stress and rewatering. Heilongjiang Agricultural Sciences, 2022 (6): 67-71.
[31] 赵龙,蔡焕杰,曹玉鑫.生育期干旱-复水对夏玉米生化指标的影响.节水灌溉,2021(6):9-16.ZHAO L, CAI H J, CAO Y X. Effect of drought stress and re-watering on biochemical indexes of summer maize during growth period. Water Saving Irrigation, 2021(6): 9-16.
[32] 刘 江,李明倩,常峻菲,等.干旱胁迫及复水对大豆关键生育时期叶片生理特性的影响.中国农业气象, 2022, 43(8): 622-632.LIU J, LI M Q, CHANG` J F, et al. Physiological characteristics of soybean leaves at different growth stages. Chinese Journal of Agrometeorology, 2022, 43(8): 622-632.
[33] JORGE T F, TOHGE T, WENDENBURG R, et al. Salt-stress secondary metabolite signatures involved in the ability of Casuarina glauca to mitigate oxidative stress. Environmental and Experimental Botany. 2019; 166:103 808.
[34] 屠玲艳,吴学谦,许海顺.水分胁迫对三叶青叶绿体超微结构及黄酮合成关键酶的影响.浙江农林大学学报, 2021, 38(3): 577-586.TU L Y, WU X Q, XU H S. Effects of water stress on chloroplast ultrastructure and key enzymes of flavonoid synthesis in Tetrastigma hemsleyanum. Journal of Zhejiang A&F University, 2021, 38(3): 577-586.
[35] DEHGHANIAN Z, HABIBI K, DEHGHANIAN M, et al. Reinforcing the bulwark: unravelling the efficient applications of plant phenolics and tannins against environmental stresses. Heliyon, 2022, 8(3): e09094.
[36] CASER M, CHITARRA W, D'ANGIOLILLO F, et al. Drought stress adaptation modulates plant secondary metabolite production in Salvia dolomitica Codd. Industrial Crops and Products, 2019, 129:85-96.
[37] TAHIR M. N, SHAHBAZI F, RONDEAU-GAGNÉ S, et al. The biosynthesis of the cannabinoids. Journal of Cannabis Research, 2021, 3: 7.
[38] DIVEKAR P A, NARAYANA S, DIVEKAR B A, et al. Plant secondary metabolites as defense tools against herbivores for sustainable crop protection. International Journal of Molecular Sciences, 2022, 23(5): 2 690.
[39] 管 娇,樊兴荣,邹红旭,等.大麻二酚对Cd和Cr胁迫下烟草生长的影响.作物杂志,2023, 39:1-9.GUAN J, FAN X R, ZHOU H X, et al. Effects of cannabidiol on tobacco growth under Cd and Cr stress. Crops, 2023, 39:1-9.
文章摘自:刘同歌,苑海鹏,叶云舒,张一宁,屈施旭,张玉红.干旱胁迫和复水对火麻生理及次生代谢产物含量的影响[J].中国医院用药评价与分析,2023,11(03):1743.002.