摘要:本发明公开了一种培养高效生产大麻二酚和多糖工业大麻不定根的方法,以工业大麻无菌苗叶片直接诱导生成不定根,节省了愈伤组织诱导环节,简化了培养基组分和激素,缩短了培养周期,提高了不定根产量;通过优化蔗糖浓度、接种密度、通气速率和动态研究等生物反应器培养条件,实现了短期内培育出能大量生产稳定的CBD和多糖的工业大麻不定根,解决现有技术中存在的不定根产量低、无法检测CBD和多糖等问题;工业大麻不定根由培养皿转至生物反应器放大培养,培育过程不受季节、气候、土壤条件的制约,降低了劳动强度和生产成本,实现了全年快速培育能够生产高CBD和多糖的不定根。
技术要点
1.一种培养高效生产大麻二酚和多糖的工业大麻不定根方法,其特征在于,包括以下步骤:
S1,诱导工业大麻无菌苗:选取工业大麻种子,消毒后接种至固体培养基上,获得工业大麻无菌苗;
S2,固体培养工业大麻不定根:无菌条件下,取工业大麻无菌苗外植体接种至诱导培养基Ⅰ中,进行不定根直接诱导培养;将诱导出的不定根进行增殖培养,得到增殖后的工业大麻不定根;
S3,悬浮培养工业大麻不定根:取增殖后的工业大麻不定根放入生物反应器中进行放大培养;
S4,收集生物反应器中培养的工业大麻不定根。
2.根据权利要求1所述的培养高效生产大麻二酚和多糖的工业大麻不定根方法,其特征在于,步骤S1中具体包括:
选取颗粒饱满的工业大麻种子,用自来水冲洗干净,并筛选出品质优良的种子,之后在无菌操作台中用75%乙醇消毒20-30s后,无菌水清洗;再用1%升汞处理9-10min,无菌水清洗,用无菌滤纸吸去种子表面的水分;
接种至固体培养基上,在25±2℃条件下光照16/8h培养15-20d,获得工业大麻无菌苗。
3.根据权利要求1所述的培养高效生产大麻二酚和多糖的工业大麻不定根方法,其特征在于,步骤S1中,所述固体培养基包括MS培养基、30-40g/L蔗糖和7-8g/L琼脂。
4.根据权利要求1所述的培养高效生产大麻二酚和多糖的工业大麻不定根方法,其特征在于,步骤S2中,工业大麻无菌苗外植体为叶片和根尖。
5.根据权利要求1所述的培养高效生产大麻二酚和多糖的工业大麻不定根方法,其特征在于,所述诱导培养基I为3/4MS-MS培养基、0.5-1mg/L的IBA、30-40g/L蔗糖和7-8g/L琼脂的培养基。
6.根据权利要求1所述的培养高效生产大麻二酚和多糖的工业大麻不定根方法,其特征在于,步骤S2中,将诱导出的不定根进行增殖培养,得到增殖后的工业大麻不定根,具体包括:在无菌条件下,选择上一步诱导状态良好的不定根切成1-2cm左右接种至增殖培养基上,所述增殖培养基包括3/4MS-MS培养基、1.5-3mg/L的IBA、30-40g/L蔗糖和7-8g/L琼脂。
7.根据权利要求2-6任一所述的培养高效生产大麻二酚和多糖的工业大麻不定根方法,其特征在于,培养基的pH=5-6。
8.根据权利要求1所述的培养高效生产大麻二酚和多糖的工业大麻不定根方法,其特征在于,步骤S3中生物反应器中的培养基包括3/4MS-MS培养基、1.5-3mg/LIBA和25-35g/L蔗糖。
9.根据权利要求1所述的培养高效生产大麻二酚和多糖的工业大麻不定根方法,其特征在于,步骤S3中生物反应器中不定根的接种密度为10-15g/L,通气速率为0.06-0.08vvm。
10.根据权利要求9所述的培养高效生产大麻二酚和多糖的工业大麻不定根方法,其特征在于,生物反应器中不定根的暗培养时间为40-50d。
技术领域
本发明涉及植物组织培育技术领域,尤其涉及一种培养高效生产大麻二酚和多糖的工业大麻不定根的方法。
技术背景
大麻(Cannabas satava L.),属于大麻科大麻属,分布于中亚、欧美等国家,作为世界上最古老的一年生农作物之一,被称为拥有最佳可被规模化开发利用潜力的药用植物。由于以植物大麻素为主的药用市场发展迅速,很多国家却明令禁止种植包括高产大麻素在内的大麻品种,于是工业大麻逐渐成为热点研究对象。
CBD是工业大麻中主要成分之一,无成瘾性,在抗癫痫、保护神经、抗炎、抑菌和抗氧化等方面极具效果,已被用于治疗多种疾病,并具备研制成出色的抗氧化剂和抗生素的潜力。植物多糖具有调节肠道、抗氧化、抗肿瘤和降血糖等药理活性,且毒副性较低,已经成为食品和医药领域产品开发的热点。由于工业大麻种植受法律限制,导致CBD严重依赖工业大麻原材料提取分离来获得。然而人工种植的工业大麻中CBD的积累受诸多因素影响,如品种、性别、年龄、生长环境和栽培方法等,这使得工业大麻原材料的品质和可用性受到了限制,无法满足市场需求。于是,寻找一种新的CBD和多糖的获取途径显得尤为重要。
植物组织培养的不定根可以聚集植物中生物活性物质并保持原植株的所有特性,较细胞培养遗传性稳定,较毛壮根培养更具安全性,不定根的代谢和活力相对更为稳定,也不受季节、气候、土壤条件的制约。生物反应器可以为植物的新陈代谢提供优良的生长环境,使目标培养物快速并优质地生长发育,实现了全年快速生产不定根,可获得更多次生代谢物质和大量的不定根,已应用于人参、地黄以及黄芪等不定根的生产。现有的工业大麻不定根培养过程较为复杂且处于初级阶段,如Farag和Kayser用愈伤组织诱导出不定根后建立了培养体系,该体系下的不定根中大麻二酚酸、四氢大麻酚酸和大麻萜酚酸含量极低,在培养28d时停止生产,也并未检测到CBD和多糖,说明现有的培养体系不适用于培养工业大麻不定根来生产CBD和多糖。因此,如何通过工业大麻不定根培养体系改进,实现规模化生产CBD和多糖成为急需解决的技术问题。
发明内容
正文内容本发明的目的在于提供一种培养高效生产大麻二酚和多糖的工业大麻不定根的方法,从而解决现有技术中存在的前述问题。
为了实现上述目的,本发明采用的技术方案如下:
一种培养高效生产大麻二酚和多糖的工业大麻不定根方法,包括以下步骤:
S1,诱导工业大麻无菌苗:选取工业大麻种子,消毒后接种至固体培养基上,获得工业大麻无菌苗;
S2,固体培养工业大麻不定根:无菌条件下,取工业大麻无菌苗外植体接种至诱导培养基Ⅰ中,进行不定根直接诱导培养;将诱导出的不定根进行增殖培养,得到增殖后的工业大麻不定根;
S3,悬浮培养工业大麻不定根:取增殖后的工业大麻不定根放入生物反应器中进行放大培养;
S4,收集生物反应器中培养的工业大麻不定根。
优选的,步骤S1中具体包括:
选取颗粒饱满的工业大麻种子,用自来水冲洗干净,并筛选出品质优良的种子,之后在无菌操作台中用75%乙醇消毒20-30s后,无菌水清洗;再用1%升汞处理9-10min,无菌水清洗,用无菌滤纸吸去种子表面的水分;
接种至固体培养基上,在25±2℃条件下光照16/8h培养15-20d,获得工业大麻无菌苗。
优选的,步骤S1中,所述固体培养基包括MS培养基、30-40g/L蔗糖和7-8g/L琼脂。
优选的,步骤S2中,工业大麻无菌苗外植体为叶片和根尖。
优选的,所述诱导培养基I为3/4MS-MS培养基、0.5-1mg/L的IBA、30-40g/L蔗糖和7-8g/L琼脂的培养基。
优选的,步骤S2中,将诱导出的不定根进行增殖培养,得到增殖后的工业大麻不定根,具体包括:在无菌条件下,选择上一步诱导状态良好的不定根切成1-2cm左右接种至增殖培养基上,所述增殖培养基包括3/4MS-MS培养基、1.5-3mg/L的IBA、30-40g/L蔗糖和7-8g/L琼脂。
优选的,培养基的pH=5-6。
优选的,步骤S3中生物反应器中的培养基包括3/4MS-MS培养基、1.5-3mg/LIBA和25-35g/L蔗糖。
优选的,步骤S3中生物反应器中不定根的接种密度为10-15g/L,通气速率为0.06-0.08vvm。
进一步优选的,生物反应器中不定根的暗培养时间为40-50d。
本发明的有益效果是:
本发明公开了一种利用生物反应器培养高效生产大麻二酚和多糖工业大麻不定根的方法,以工业大麻无菌苗叶片直接诱导生成不定根,节省了愈伤组织诱导环节,简化了培养基组分和激素,缩短了培养周期,提高了不定根产量;通过优化蔗糖浓度、接种密度、通气速率和动态研究等生物反应器培养条件,实现了短期内培育出能大量生产稳定的CBD和多糖的工业大麻不定根,解决现有技术中存在的不定根产量低、无法检测CBD和多糖等问题;工业大麻不定根由培养皿转至生物反应器放大培养,培育过程不受季节、气候、土壤条件的制约,降低了劳动强度和生产成本,实现了全年快速培育能够生产高CBD和多糖的不定根。
附图说明
此处的附图被并入说明书中并构成本说明书的一部分,示出了符合本申请的实施例,并与说明书一起用于解释本申请的原理。
为了更清楚地说明本申请实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,对于本领域普通技术人员而言,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1是本发明中的工业大麻不定根分别在培养皿(a)、摇瓶(b)和生物反应器(c)中生长状态的示意图。
图2是高效液相色谱仪检测实施例1中的培养方法得到的工业大麻不定根中的CBD含量,其中(a)是CBD和CBG标准品检测峰;(b)是工业大麻不定根中CBD和CBG的检测峰。
图3是实验例中的蔗糖浓度影响工业大麻不定根生长和CBD及多糖积累的示意图。
图4是实验例中的接种密度影响工业大麻不定根生长和CBD及多糖积累的示意图。
图5是实验例中的通气速率影响工业大麻不定根生长和CBD及多糖积累的示意图。
图6是本申请实施例的工业大麻不定根生长动态研究的示意图。
图7是本申请实施例的利用生物反应器高效培养工业大麻不定根生产大麻二酚和多糖的流程图。
具体实施方法
正文内容本申请的各种实施例可以以一个范围的形式存在;应当理解,以一范围形式的描述仅仅是因为方便及简洁,不应理解为对本申请范围的硬性限制;因此,应当认为所述的范围描述已经具体公开所有可能的子范围以及该范围内的单一数值。例如,应当认为从1到6的范围描述已经具体公开子范围,例如从1到3,从1到4,从1到5,从2到4,从2到6,从3到6等,以及所述范围内的单一数字,例如1、2、3、4、5及6,此不管范围为何皆适用。另外,每当在本文中指出数值范围,是指包括所指范围内的任何引用的数字(分数或整数)。
在本申请中,在未作相反说明的情况下,使用的方位词如“上”和“下”具体为附图中的图面方向。另外,在本申请说明书的描述中,术语“包括”“包含”等是指“包括但不限于”。在本文中,诸如“第一”和“第二”等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。在本文中,“和/或”,描述关联对象的关联关系,表示可以存在三种关系,例如,A和/或B,可以表示:单独存在A,同时存在A和B,单独存在B的情况。其中A,B可以是单数或者复数。在本文中,“至少一个”是指一个或者多个,“多个”是指两个或两个以上。“至少一种”、“以下至少一项(个)”或其类似表达,是指的这些项中的任意组合,包括单项(个)或复数项(个)的任意组合。例如,“a,b,或c中的至少一项(个)”,或,“a,b,和c中的至少一项(个)”,均可以表示:a,b,c,a-b(即a和b),a-c,b-c,或a-b-c,其中a,b,c分别可以是单个,也可以是多个。
除非另有特别说明,本申请中用到的各种原材料、试剂、仪器和设备等,均可通过市场购买得到或者可通过现有方法制备得到。
本发明提供了一种培养高效生产大麻二酚和多糖的工业大麻不定根的方法,包括以下步骤:
S1,诱导工业大麻无菌苗:选取工业大麻种子,消毒后接种至固体培养基上,获得工业大麻无菌苗;
S2,固体培养工业大麻不定根:无菌条件下,取工业大麻无菌苗外植体接种至诱导培养基Ⅰ中,进行不定根直接诱导培养;将诱导出的不定根进行增殖培养,得到增殖后的工业大麻不定根;
S3,悬浮培养工业大麻不定根:取增殖后的工业大麻不定根放入生物反应器中进行放大培养;
S4,收集生物反应器中培养的工业大麻不定根。
在一些实施方式中,步骤S1中具体包括:
选取颗粒饱满的工业大麻种子,用自来水冲洗干净,并筛选出品质优良的种子,之后在无菌操作台中用75%乙醇消毒20-30s后,无菌水清洗;再用1%升汞处理9-10min,无菌水清洗,用无菌滤纸吸去种子表面的水分;
接种至固体培养基上,在25±2℃条件下光照16/8h培养15-20d,获得工业大麻无菌苗。
在一些实施方式中,步骤S1中,所述固体培养基包括MS培养基、30-40g/L蔗糖和7-8g/L琼脂。
在一些实施方式中,步骤S2中,工业大麻无菌苗外植体为叶片和根尖。
在一些实施方式中,所述诱导培养基I为3/4MS-MS培养基、0.5-1mg/L的IBA、30-40g/L蔗糖和7-8g/L琼脂的培养基。
在一些实施方式中,步骤S2中,将诱导出的不定根进行增殖培养,得到增殖后的工业大麻不定根,具体包括:在无菌条件下,选择上一步诱导状态良好的不定根切成1-2cm左右接种至增殖培养基上,所述增殖培养基包括3/4MS-MS培养基、1.5-3mg/L的IBA、30-40g/L蔗糖和7-8g/L琼脂。
在一些实施方式中,培养基的pH=5-6。
在一些实施方式中,步骤S3中生物反应器中的培养基包括3/4MS-MS培养基、1.5-3mg/L IBA和25-35g/L蔗糖。
在一些实施方式中,步骤S3中生物反应器中不定根的接种密度为10-15g/L,通气速率为0.06-0.08vvm。
在一些实施方式中,生物反应器中不定根的暗培养时间为40-50d。
下面结合具体的实施例,进一步阐述本申请。应理解,这些实施例仅用于说明本申请而不用于限制本申请的范围。下列实施例中未注明具体条件的实验方法,通常按照国家标准测定。若没有相应的国家标准,则按照通用的国际标准、常规条件、或按照制造厂商所建议的条件进行。
实施例
本实施例提供了一种培养高效生产大麻二酚和多糖的工业大麻不定根的方法,包括以下步骤:
1.1工业大麻无菌苗的诱导
选取颗粒饱满的工业大麻种子,用自来水冲洗干净,并筛选出品质优良的种子,之后在无菌操作台中用75%乙醇消毒20-30s后,无菌水清洗;再用1%升汞处理9-10min,无菌水清洗,用无菌滤纸吸去种子表面的水分,接种至含MS培养基、30-40g/L蔗糖和7-8g/L琼脂的固体培养基上,在25±2℃条件下光照16/8h(光照/黑暗)培养15-20d,获得生长状态较好的工业大麻无菌苗,备用;
1.2工业大麻不定根固体培养
为了筛选出最佳的固体培养条件,分别进行了以下的筛选实验过程:
(1)外植体类型筛选
在无菌条件下,分别切取6-9个工业大麻无菌苗叶片(1×1cm)、茎段(1-2cm)和根尖(1-2cm)接种至含1/2MS-MS培养基、0.5-1mg/L的IBA、30-40g/L蔗糖和7-8g/L琼脂的诱导培养基(pH=5-6)中,进行不定根的直接诱导培养,每个水平10个重复,收集不定根,调查其生物量。
结果见表1,当接种叶片和根约7d后,长出不定根;培养30-40d后,不定根生长状态较好,叶片、茎段和根的不定根诱导率分别达到93%、85%和98%,其鲜重达到0.44g/L,干重达到0.04g/L。说明叶部更适合用于工业大麻不定根的诱导培养。
表1外植体类型对工业大麻不定根诱导培养的影响
|
外植体类型 |
诱导时间(d) |
诱导率(%) |
鲜重(g/L) |
干重(g/L) |
|
叶片 |
7±0.07 |
98±0.01 |
0.44±0.03 |
0.04±0.01 |
|
茎段 |
10±0.06 |
85±0.02 |
0.23±0.02 |
0.02±0.01 |
|
根尖 |
7±0.09 |
93±0.01 |
0.34±0.03 |
0.03±0.01 |
注:数值以平均值±标准差(n=10)表示。
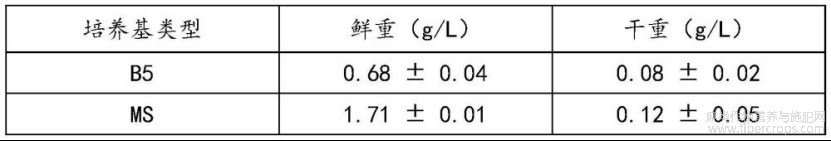
(2)增殖培养基类型筛选
为了筛选出最佳增殖培养基种类,将上一步的不定根培养6代后,分别接种在含B5、MS、1/2MS和WPM培养基中,并在每个培养基中均添加1mg/L的IBA、30g/L蔗糖和7g/L琼脂(pH=5-6),在25±2℃条件下暗培养40d,收集不定根,并调查不定根的生物量。
结果见表2所示,接种在含有MS培养基中的不定根的生物量鲜重和干重分别为1.71±0.01g/L和0.12±0.01g/L,明显高于其他培养基中培养得到的不定根的鲜重和干重。说明MS培养基有利于不定根的生长。
表2培养基类型对工业大麻不定根增殖培养的影响
注:数值以平均值±标准差(n=10)表示。
(3)盐强度筛选
将诱导培养获得的不定根分别接种至含1/4MS、1/2MS、3/4MS和MS培养基中,并且每个培养基中均添加2mg/L的IBA、30g/L蔗糖和8g/L琼脂(pH=5-6),在25±2℃条件下暗培养40d,收集不定根,并调查不定根的生物量。
结果见表3,在培养基浓度从1/4MS到3/4MS的条件下,不定根的生物量逐渐增加。在3/4MS培养基中,不定根的鲜重(1.76±0.01g/L)和干重(0.22±0.02g/L)达到最高,高于3/4MS时,生物量略有降低,但并无显著变化。故在实际培养过程中选择3/4MS-MS为适宜的盐强度。
表3盐强度对工业大麻不定根增殖培养的影响
|
盐强度 |
鲜重(g/L) |
干重(g/L) |
|
1/4MS |
1.24±0.03 |
0.26±0.01 |
|
1/2MS |
1.32±0.02 |
0.20±0.01 |
|
3/4MS |
1.76±0.06 |
0.24±0.02 |
|
MS |
1.71±0.01 |
0.22±0.02 |
注:数值以平均值±标准差(n=10)表示。
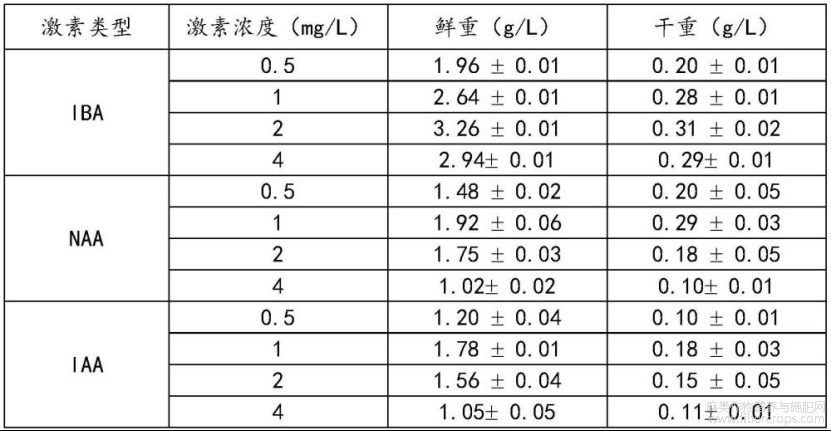
(4)激素类型和浓度筛选
为提升不定根的产量,分别评估了IBA、萘乙酸(NAA)和吲哚乙酸(IAA)激素对不定根生长的影响,具体实验步骤如下:
将诱导获得的不定根分别接种至含不同激素种类(IBA、NAA和IAA)及浓度(0.5-4mg/L)的培养基中,培养基包括3/4MS培养基、30g/L蔗糖和7g/L琼脂,pH=5,在25±2℃条件下暗培养30d后,收集不定根,并调查不定根的生物量。
结果见表4,IBA处理的不定根生物量及生长状态要优于其他生长素处理组(NAA和IAA),当培养基中添加2mg/L的IBA时,不定根鲜重(3.26±0.01g/L)和干重(0.31±0.02g/L)要高于1mg/L NAA和IAA的最佳处理组。而IAA(1mg/L)和NAA(1mg/L)对不定根生长的促进作用不太明显。故在实际培养过程中选择1.5-3mg/L的IBA为适宜的激素条件。
表4激素对工业大麻不定根增殖培养的影响
注:数值以平均值±标准差(n=10)表示。
为了进一步准确确定收集到的不定根中的多糖及CBD含量,本发明中采用液相色谱测定不定根中的多糖以及CBD含量,具体测试方法如下所示:
(1)待测样品的制备
将不定根冻干样品(0.1g)按照固液比(1:30)浸入90%(v/v)甲醇中,在50℃下超声提取30min后过滤,重复提取3次,合并滤液作为待测样品。
(2)CBD和大麻萜酚(CBG)含量测定
取待测样品经0.22μm有机滤膜过滤后,采用高效液相色谱法测定。选用的色谱柱为C18反相色谱柱(4.6mm×250mm,5μm),波长225nm。流动相为乙腈(A)-水(B),等度洗脱0~20min,A:80%。流动相流速为1mL/min,CBD标准品的制备梯度浓度0.02-0.2mg/mL。通过分析标准品浓度与峰面积的关系,构建标准曲线,计算CBD在不定根中的含量。但不定根中并未检测到CBG物质。
(3)多糖含量检测
取0.5mL待测样品和0.5mL的80%甲醇溶液混匀,加入1mL 5%的苯酚,然后再加入5mL浓硫酸,反应30min后,用紫外分光光度计检测490nm的吸光度。以葡萄糖为标准品,不定根中总多糖的含量以毫克葡萄糖(纯化≥98)当量/g DW样品表示。
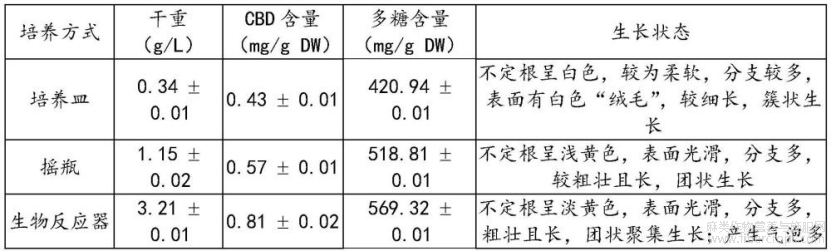
2.1验证培养方式对工业大麻不定根的影响
为便于将来工业大麻不定根的大规模生产,对比了固体培养、摇瓶和生物反应器培养的不定根中CBD和多糖含量。
在无菌条件下,取6-9个工业大麻不定根剪切至1-2cm左右接种到3/4MS-MS培养基、1.5-3mg/L IBA、30-40g/L蔗糖以及7-8g/L琼脂(pH=5-6)的培养皿中进行固体培养;选取6-8g/L新鲜的不定根接种至含100-200mL液体培养基的摇瓶中进行振荡培养,在25±2℃的90-110r/min转速下暗培养30-40d,收获不定根;再将4-6g/L新鲜的不定根剪切至1-2cm左右放入装有1-2L液体培养基的3L气升式生物反应器中,将通气速率调至0.05-0.1vvm,在25±2℃下暗培养30-40d。
结果见表5、图1和图2所示,从图1中可发现摇瓶中生长的不定根呈淡黄色,且较长,表面并无白色“绒毛”,团状生长,其干重明显高于固体培养,经液相测试后不定根中CBD和多糖含量也显著提升,分别达到0.57±0.01mg/g DW和518.81±0.01mg/g DW。而生物反应器中培养的不定根较长,产生较多的气泡,其形态与摇瓶中的较为相似,不定根的干重提高至3.21±0.01g/L,明显高于固态培养以及摇瓶培养。此外,经过液相检测,发现生物培养器中的不定根积累了较多的CBD和多糖(0.81±0.02mg/g DW和569.32±0.01mg/g DW),显著高于其他两种培养方式,由此说明生物反应器能够培养出高效生产CBD和多糖的工业大麻不定根。
表5培养皿、摇瓶和生物反应器中不定根生长和CBD及多糖积累的结果
注:数值以平均值±标准差(n=5)表示。
2.2工业大麻不定根生物反应器培养体系的建立
(1)筛选蔗糖浓度
在无菌条件下,取增殖培养后的不定根在生物反应器中进行2-3代增殖培养后,将4g/L新鲜的不定根剪切至1-2cm左右放入含3/4MS-MS培养基、1.5IBA和10-40g/L蔗糖的1-2L液体培养基(pH=5-6)的3L气升式生物反应器中,将通气速率调至0.05vvm,在25±2℃下暗培养30d后收集不定根,调查不定根的生物量,并检测不定根中CBD及多糖含量。
结果见图3,当培养基中的蔗糖浓度由10g/L逐渐升高至30g/L时,不定根的生物量和CBD及多糖含量逐渐增加;蔗糖浓度高于30g/L时,不定根生物量和CBD及多糖含量逐渐降低。故在实际规模化培养工业大麻不定根过程中选择25-35g/L为适宜的蔗糖浓度,更有助于不定根的生长以及CBD及多糖含量的积累。
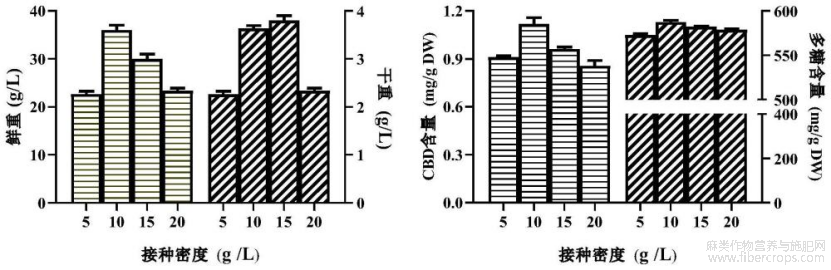
(2)筛选接种密度
分别取增殖培养后的5-20g/L新鲜工业大麻不定根接种至装有含3/4MS培养基、1.5mg/L IBA和25g/L蔗糖的液体培养基的生物反应器中,将通气速率调至0.05vvm,暗培养30d时,收集不定根进行检测。
结果见图4,当在生物反应器中接入5-10g/L不定根时,其生物量逐渐上升,此时CBD和多糖含量也在增加;当接种密度高于10g/L时,不定根的生物量和CBD及多糖含量逐渐降低。故在实际规模化培养工业大麻不定根过程中选择10-15g/L为适宜的接种密度。
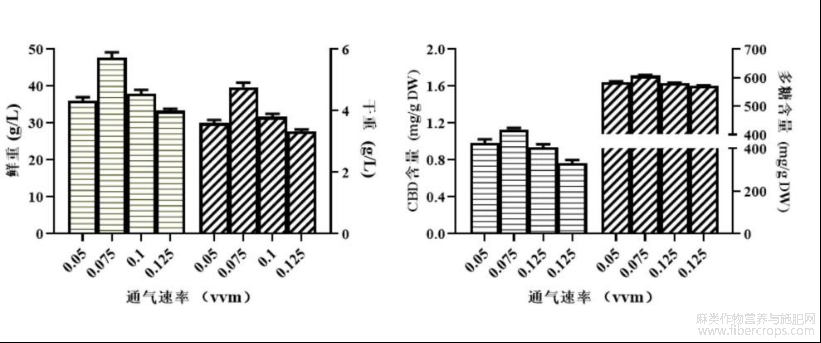
(3)筛选通气速率
取增殖培养后的的10g/L新鲜工业大麻不定根接种至装有含3/4MS培养基、1.5mg/L IBA和25g/L蔗糖的培养基中,分别将通气速率调至0.05-0.125vvm,暗培养30d时,收集不定根进行调查。
结果见图5,通气速率在0.075vvm时,不定根生长状态和CBD及多糖含量明显提高。故在实际规模化培养工业大麻不定根过程中可选择0.06-0.08vvm为适宜的通气速率。
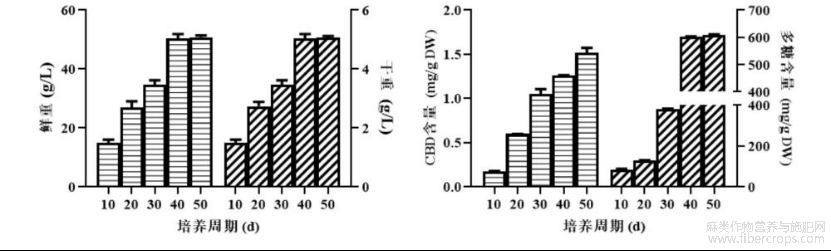
(4)动态研究
取增殖培养后的10/L新鲜工业大麻不定根接种至装有含3/4MS培养基、1.5mg/LIBA和25g/L蔗糖的培养基中,将通气速率调至0.06vvm,分别暗培养10-50d,收集不同时间段的不定根进行调查。
结果见图6,不定根培养至40-50d时,其生物量和CBD及多糖含量明显升高。故在实际规模化培养工业大麻不定根过程中可选择培养周期为40-50d。
综上所述,本申请提供的培养方法,能够提高工业大麻叶片诱导的不定根成功率,优化的增殖培养基的培养条件为3/4MS-MS培养基、1.5-3mg/L的IBA和30-40g/L蔗糖浓度可明显提高不定根产量,此时不定根的长势较好,培养周期短;此外,不定根在含3/4MS-MS培养基、1.5-3mg/L IBA和25-35g/L蔗糖液体培养基的生物反应器中接种10-15g/L不定根,通气速率设为0.06-0.08vvm,暗培养40-50d时,此时不定根的干重及其CBD和多糖含量与摇瓶相比,分别提升了8.95倍、3.47倍和1.18倍。进一步说明采用本发明中的生物反应器培养体系得到的工业大麻不定根能够培养出高效生产CBD和多糖,该培养方式也具备规模化生产的潜力。
因此,本申请不仅可以提高工业大麻不定根产量、CBD和多糖的积累,同样也成功地实现了工业大麻不定根的扩大培养,为利用植物组织培养技术生产CBD和多糖提供了技术参考,也为解决人工栽培的工业大麻中CBD产量低的卡脖子难题建立了新途径。
通过采用本发明公开的上述技术方案,得到了如下有益的效果:
本发明公开了一种利用生物反应器培养高效生产大麻二酚和多糖工业大麻不定根的方法,以工业大麻无菌苗叶片直接诱导生成不定根,节省了愈伤组织诱导环节,简化了培养基组分和激素,缩短了培养周期,提高了不定根产量;通过优化蔗糖浓度、接种密度、通气速率和动态研究等生物反应器培养条件,实现了短期内培育出能大量生产稳定的CBD和多糖的工业大麻不定根,解决现有技术中存在的不定根产量低、无法检测CBD和多糖等问题;工业大麻不定根由培养皿转至生物反应器放大培养,培育过程不受季节、气候、土壤条件的制约,降低了劳动强度和生产成本,实现了全年快速培育能够生产高CBD和多糖的不定根。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视本发明的保护范围。
摘自国家发明专利,发明人:付玉杰;安晓丽;杨杰;焦骄;张谡;李洪权,申请号:202311141683.8,申请日:2023.09.05