摘 要:为了探索相同配方培养基条件下不同苎麻种质体细胞植株再生体系的差异,为苎麻组织培养及品种改良提供理论依据,本试验以6个苎麻种质(湘饲苎X4?湘饲苎X6?湘饲苎X7?A?B?C)为材料,采用相同配方的培养基进行培养,比较分析6个苎麻种质的愈伤诱导率?不定芽诱导率和再生苗生根率?结果表明:以附加TDZ(噻苯隆,0.05mg/L)?2,4-D(2,4-二氯苯氧乙酸,0.03mg/L)和IAA(吲哚乙酸,0.01mg/L)的MS培养基为愈伤诱导培养基时,湘饲苎X4?湘饲苎X6?湘饲苎X7?A?B和C的愈伤诱导率分别为76.67%?40.00%?30.00%?90.00%?90.00%和96.67%;以附加TDZ(0.5mg/L)?2,4-D(0.02mg/L)和IAA(0.03mg/L)的1/2MS培养基为不定芽诱导培养基时,湘饲苎X4?湘饲苎X6?湘饲苎X7?A?B和C的不定芽诱导率分别为11.62%?8.33%?5.88%?24.52%?21.15%和31.57%;以附加TDZ(0.02mg/L)?NAA(萘乙酸,0.05mg/L)和IAA(0.02mg/L)的MS培养基为生根培养基时,湘饲苎X4?湘饲苎X6?湘饲苎X7?A?B和C的生根率都是100%?湘饲苎X7的愈伤诱导率和不定芽诱导率均最低,分别为30.00%和5.88%;C的愈伤诱导率和不定芽诱导率均最高,分别为96.67%和31.57%?综合分析,基因型对苎麻外植体愈伤组织诱导和不定芽形成具有重要影响?
关键词:火苎麻;种质;组织培养;不定芽;植株再生
在苎麻(Boehmerianivea)为荨麻科(Urticaceae)苎麻属(Boehmeria)的多年生草本植物,主要分布在热带和亚热带地区,在世界上享有“中国草”(China grass)之誉称?其栽培历史在4000年以上,是我国最先利用的天然纤维之一?苎麻组织培养技术在苎麻品种改良?种质资源的繁殖和保存?杂种优势的固定和遗传转化等方面具有重要作用?高再生率的体细胞再生体系对开展体细胞无性系变异规律研究及其种质创新极为有利?迄今为止,苎麻离体再生体系的研究已取得了一定的进展,研究内容涉及基因型?激素?外植体类型?基本培养基等,但仍存在基因型差异显著?植株再生频率低?可重复操作性差等问题?本试验研究苎麻种质基因型对体细胞植株再生的影响,以为苎麻的组织培养及植株再生提供理论依据?
1 材料与方法
1.1 试验材料
试验采用6个苎麻种质,分别是湘饲苎X4?湘饲苎X6?湘饲苎X7?A?B和C,均由湖南农业大学苎麻研究所提供?
1.2 试验方法
将6个苎麻种质种苗移栽于装有营养土的盆中进行培养,等植株长出新叶后,取嫩叶作为外植体,每个种质各接种30片,3个重复共90片,用毛笔轻轻刷去杂质,用自来水冲洗,滤纸吸干,在超净工作台上用75%酒精浸洗25s后,用无菌水冲洗3遍,再用0.1%升汞消毒7min,用无菌水冲洗5遍后,在无菌滤纸上将叶片切成0.5cm×0.5cm的方块,并将其接种于愈伤组织诱导培养基上?将叶块的下表皮贴于培养基上,于暗室中诱导愈伤组织,一般5d后愈伤基本形成?10d后将愈伤转接于不定芽诱导培养基上,培养条件:白天温度26±2℃,夜间为20±2℃,每天光照11h,光照强度为1500~2000Lx?愈伤组织通过多次继代,分化出不定芽,再将不定芽转接在壮苗培养基上壮苗,待不定芽长至2~3cm时,再将其转接于生根培养基中,10d后可以长出新根,即为完整的再生植株?愈伤组织?不定芽和根的诱导均设3次重复?
1.3 培养基配方
愈伤组织诱导培养基:MS培养基+TDZ(噻苯隆,0.05mg/L)+2,4-D(2,4-二氯苯氧乙酸,0.03mg/L)+IAA(吲哚乙酸,0.01mg/L)?
不定芽诱导培养基:1/2MS培养基+TDZ(0.5L)+2mg/L,4-D(0.02mg/L)+IAA(0.03mg/L)?
壮苗培养基:MS+TDZ(0.05mg/L)+IAA(0.05mg/L)?
生根培养基:MS+TDZ(0.02mg/L)+NAA(0.05mg/L)+IAA(0.02mg/L)?
1.4 数据处理及方法
采用Excel2010对数据进行初步整理,用DPS9.01软件进行方差分析?本研究根据以下公式计算组织培养处理的愈伤组织诱导率?不定芽诱导率和生根率:
愈伤组织诱导率(%)=(产生愈伤组织的叶片数/接种的叶片数)×100;
不定芽诱导率(%)=(产生不定芽的愈伤组织块数/接种的愈伤组织块数)×100;
生根率(%)=(生根小苗数/接种的不定芽数)×100?
2 结果与分析
2.1 愈伤组织诱导
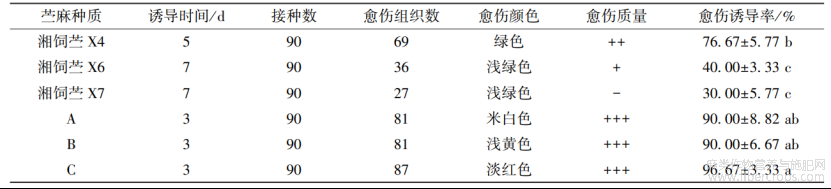
6个苎麻种质愈伤组织的诱导结果见表1和图1?
在时间上,种质A?B和C在接种后第2天叶片出现膨大,第3天诱导出愈伤组织,湘饲苎X4在第5天出现愈伤组织,湘饲苎X6和湘饲苎X7脱分化的时间最长,第7天才诱导出愈伤组织,且长出的愈伤组织不整齐?颜色上,A?B和C分别出现了米白?浅黄和淡红等颜色,其他3个种质的愈伤组织颜色较一致?在愈伤组织的质量上,A?B和C的愈伤组织长势相对较强,质地疏松,成小瘤﹑颗粒状,且愈伤组织诱导率也较高,其中,C的愈伤诱导率最高,达96.67%,A和B的愈伤诱导率均为90.00%;湘饲苎X6和湘饲苎X7的愈伤组织长势较弱,尤其是湘饲苎X7,愈伤组织质地呈蓬松状,少量的愈伤还出现了变褐现象,其愈伤组织诱导率最低,为30.00%,湘饲苎X6为40.00%;湘饲苎X4的愈伤组织诱导率为76.67%,处于中间位置,高于湘饲苎X6和湘饲苎X7,但低于A?B和C?
表1不同苎麻种质愈伤组织的诱导结果
“-”表示生长缓慢,生长势弱;“+”表示生长势一般;“++”表示生长势较强;“+++”表示生长势很强?小写字母不同表示种质间差异显著(P<0.05)?
图1 干旱胁迫对火麻叶片相对含水量的影响
2.2 不定芽诱导
将6个种质的愈伤组织转接在不定芽诱导培养基上,每隔3d观察1次,每隔3个星期继代1次,观察并记录结果(表2,图2)?根据表2,第1次继代后,每个种质都出现了不同程度的变褐现象,其中湘饲苎X4?湘饲苎X6和湘饲苎X7较严重,变褐的愈伤组织最后都出现死亡的现象,严重影响了不定芽诱导率;湘饲苎X4?湘饲苎X6和湘饲苎X7的不定芽诱导率分别为11.62%?8.33%?5.88%;种质A?B?C的情况较好,特别是种质C?第2次继代后,愈伤组织分化出了少量的芽和簇芽,其中B有15块愈伤分化出了根,A的愈伤转绿,质地致密?第3次继代后,A和B均分化出了芽,由于B分化了根,不利于芽和苗的再生,A的不定芽诱导率(24.52%)稍高于B(21.15%),不定芽诱导率最高的是种质C(31.57%)?
表2不同苎麻种质不定芽诱导结果
图2不同苎麻种质愈伤组织9周后诱导出的不定芽
2.3 壮苗培养情况
由于愈伤组织上长出来的不定芽太小,生长能力弱,不能直接接种在生根培养基中生根,而需要在壮苗培养基中继续培养壮苗?即将诱导出不定芽的愈伤块转接在附加TDZ(0.05mg/L)和IAA(0.05mg/L)的MS培养基中,每隔3d观察1次,15d后观察发现,大部分不定芽生长较好,茎秆粗,叶子葱绿,也有少许不定芽生长较慢,芽苗较矮,叶子较小?
2.4 根的诱导
待不定芽长至2~3cm,将其转接在附加TDZ2mg/L)?IAA(0.02mg/L)和NAA(0.05mg/L)的MS培养基上,10d后,6个种质全部生根?开始根少且短,植株矮小,1周后,整个三角瓶的底部都布满了根,植株也随着长高长大,从而形成了完整的再生植株?
图3 不同苎麻种质的不定芽生根情况(转接至生根培养基后17d)
3 讨论
潘昌立等研究发现,基因型是苎麻外植体诱导愈伤组织和再生植株的决定因素,在相同培养条件下,不同基因型苎麻叶愈伤组织的绿芽诱导率表现为:湘苎6号(36.0%)>湘苎2号(34.0%)>Q8(20.0%)>芦竹青(8.8%)>湘苎3号(3.3%)>C5(2.9%)?刘瑛等研究发现,基因型和培养基组分是影响苎麻体细胞植株再生的内因和主要外因,不同基因型苎麻叶愈伤组织的绿芽诱导率表现为:细野麻(36.0%)>赣苎3号(33.4%)>湘苎2号(32.0%)>89-12(20.0%)>湘苎3号(3.3%)?马雄风研究发现,在相同培养条件下,不同基因型苎麻下胚轴愈伤的芽再生频率表现为:中饲苎1号(83.77%)>中苎1号(81.77%)>NC01(80.59%);子叶愈伤组织的芽再生频率表现为:NC01(60.29%)>中苎1号(57.14%)>中饲苎1号(50.51%)?王晓玲等将湘苎6号和湘苎2号的叶片在附加2.5mg/L6-BA和0.5mg/L2,4-D的MS?MSB?LS?B5和N6等5种培养基上进行培养,发现湘苎2号叶愈伤组织量均高于湘苎6号?王晓玲和彭定祥研究发现,在附加0.5~2.5mg/L6-BA和0.5mg/LNAA,0.5-2.5mg/L6-BA和0.5mg/L2,4-D的MS培养基上进行培养,黄壳早?湘苎2号?华苎3号和巴西麻6号适应性强,脱分化和分化均较容易,但华苎1号脱分化难?Wang等研究发现,苎麻不定芽再生情况取决于基因型,将6种苎麻基因型在附加2.27μMTDZ和0.057μMIAA或2.27μMTDZ和0.054μMNAA的MS培养基上培养,5041-3的不定芽诱导率最高,分别为86.2%和64.5%,黄皮棍的不定芽诱导率最低,分别为46.5%和33.4%?
4 结论
本研究中,6个苎麻种质的愈伤诱导率均较高,种质C的愈伤诱导率最高,达96.67%,湘饲苎X7的愈伤诱导率最低,为30.00%;而6个种质的不定芽诱导率却相对较低,种质C的不定芽诱导率最高,为31.57%,湘饲苎X7的不定芽诱导率最低,仅为5.88%?综合分析,基因型是影响苎麻外植体愈伤组织诱导和不定芽形成的重要因素
参考文献
[1] 汪波,彭定祥.苎麻组织培养及遗传转化研究进展[J].中国麻业科学,2007,29(1):9-15.
[2] 马雄风,喻春明,唐守伟,等.苎麻组织培养和遗传转化研究进展[J].分子植物育种,2008,6(5):967-970.
[3] 秦红霞,刘鑫.苎麻组织培养研究进展[J].江西棉花,2007,29(6):6-9.
[4] 伍旭东,揭雨成,徐庆国.苎麻再生体系的建立及转基因研究进展[J].作物研究,2007,21(S1):685-689.
[5] 潘昌立,李树川,李育君.苎麻体细胞植株再生及其影响因素的研究[J].中国麻作,1995,17(1):1-6.
[6] 刘瑛,黄小英,赖小萍,等.苎麻组织培养再生植株主要影响因素的研究[J].江西农业学报,2002,14(1):11-15.
[7] 马雄风.苎麻抗虫基因遗传转化研究[D].北京:中国农业科学院,2009.
[8] 王晓玲,彭定祥,陈小慧.基本培养基对苎麻不同外植体愈伤诱导及分化的影响[J].华中农业大学学报,2003,22(5):431-435.
[9] 王晓玲,彭定祥.不同基因型对苎麻愈伤组织诱导及分化的影响[J].长江大学学报(自科版),2005,2(8):64-66,6.
[10] WANG B , PENGD, LIULJ, etal. An efficient adventitious shoot regeneration system for ramie (Boehmeria nivea gaud) using thidiazuron [J]. Botanical Studies, 2007,48:173-181.
[11] 孔华,郭安平,章霄云,等.苎麻遗传转化再生体系的建立[J].分子植物育种,2006,4(2):233-237.
[12] 杨金雨.根癌农杆菌介导雄性不育基因(barnase)转化苎麻研究[D].武汉:华中农业大学,2009.
[13] 曹雅琴,刘峰,陈建荣,等.苎麻叶片高效再生体系的建立[J].湖南农业大学学报(自然科学版),2009,35(2):116-122.
[14] 曹雅琴.苎麻高效再生体系的建立及相关生理指标的研究[D].长沙:湖南农业大学,2009.
[15] 胡凌红,李同建,韩兴杰,等.苎麻品种“赣苎3号”下胚轴愈伤组织诱导及分化的研究[J].南方林业科学,2015,43(1):4-7.
[16] 孙群香.苎麻叶片高效再生体系建立与遗传转化方法探索[D].长沙:湖南农业大学,2016.
[17] 颜昌敬,赵庆华,胡继金,等.苎麻组织培养及其在快速繁殖上的应用[J].中国农业科学,1982,15(2):1-8,96.
[18] 蒋建雄.苎麻的分子育种研究[D].长沙:湖南农业大学,2000.
[19] 易自力,李祥,蒋建雄,等.苎麻再生体系的建立及抗虫转基因苎麻的获得[J].中国麻业,2006,28(2):61-66.
[20] 伍旭东,邢虎成,揭雨成,等.苎麻叶片组织培养再生植株的研究[J].中国农学通报,2009,25(23):86-89.
[21] 伍旭东.苎麻高效再生体系的建立及抗虫Bt基因的遗传转化[D].长沙:湖南农业大学,2009.
[22] 何鹏亮,蒋美艳,邓淑琼,等.苎麻体细胞植株再生体系优化研究[J].中国农学通报,2020,36(12):104-110.
文章摘自:何鹏亮,蒋美艳,邢虎成,揭雨成.苎麻种质基因型对体细胞植株再生的影响[J].作物研究,2023,37(5):519-524.