摘 要:基于罗布麻叶(Apocynum Veneti Folium, AVF)优良的生物活性成分,采用绿色生物还原法,以罗布麻叶提取物为还原剂和稳定剂合成纳米银(AgNPs),并将其与壳聚糖/聚环氧乙烷(CS/PEO)混合,通过静电纺丝技术将共混聚合物制备功能性复合纳米纤维。利用场发射扫描电子显微镜(FESEM)、傅里叶红外光谱(FTIR)、能量色散 X 射线(EDS)进行表征,测定评估纳米纤维膜生物材料特性。结果表明,FESEM 显示纳米颗粒均匀地分散在纤维表面。添加罗布麻叶提取物介导合成的 AgNPs 改善了纳米纤维膜力学性能、表面润湿性以及紫外线阻隔性能。与不含 AgNPs 和添加 AgNPs 的纳米纤维膜相比,抗氧化试验表明制备的纳米银/壳聚糖-聚环氧乙烷(AgNPs/CS-PEO)复合纳米纤维膜表现出较优的自由基清除活性。抗菌试验表明,纳米银/壳聚糖-聚环氧乙烷(AgNPs/CS-PEO)复合纳米纤维膜对金黄色葡萄球菌和大肠埃希菌表现出 100%的抗菌活性。鉴于 AgNPs/CS-PEO 复合纳米纤维膜优异的特性,其有望在生物医用领域得到更广泛的应用。
关键词:壳聚糖/聚环氧乙烷;纳米银;绿色合成;抗氧化性能;抗菌性能
皮肤作为人体的第一道防线,能维持正常的生理功能并防止微生物入侵[1]。长期以来,抗生素一直是治疗伤口感染的主要药物[2-3]。然而,抗生素的研发进展缓慢,新型抗生素的开发周期较长以及抗生素的滥用等问题,导致耐药细菌感染日益严重,给医疗系统和经济带来巨大压力[4],因此,开发新型伤口感染治疗材料成为当前亟待解决的课题。
在众多材料中,纳米银(silver nanoparticles,AgNPs)凭借其小尺寸效应、表面效应和量子效应,展现出广谱抗菌、持久抑菌以及抗耐药性[5]等独特优势,被广泛应用于生物医学、纺织业、食品包装、催化剂、传感器等[6]多个领域。绿色合成的纳米颗粒具有较高安全性和良好的抗菌效果,可减少抗生素的过度使用和抗真菌治疗[7]需求。现代药理研究表明,罗布麻(Apocynum venetum L.)作为天然药用植物,其有效成分包括黄酮类、萜类化合物、甾类化合物、苯丙素类化合物、有机酸、多糖和挥发油等[8],具有降血压、心血管保护、抗氧化、抗癌特性和抗感染等多重功效[8-9]。类黄酮作为罗布麻叶(Apocynum Veneti Folium,AVF)的主要成分,是天然抗氧化剂和抗菌剂的优质原料,能够有效清除自由基[10]。因此,罗布麻叶提取物不仅是绿色合成AgNPs的理想原料,其生物活性能够赋予纳米银良好的生物活性,在控制伤口愈合过程中的氧化应激方面具有广阔的应用前景。此外,与传统抗菌复合材料相比,该材料具有制备方法简便、抗菌性能优越、环保经济等显著优势。
相关研究表明,通过静电纺丝技术,利用活性化合物的受控释放及增强纳米添加剂在生物聚合物基质中的分散性,可优化生物聚合物基材料的物理化学与功能特性[11]。纳米颗粒因其小尺寸效应、高比表面积及独特的物理化学性质,可有效促进细胞裂解,提升细胞膜通透性。此外,纳米颗粒与植物化学物质相互作用产生独特的治疗特性[12],能够迅速、选择性地附着在不同生物材料表面,实现药物和活性成分的快速、靶向及持续释放。壳聚糖(CS)作为甲壳素脱乙酰基产物,具有良好的生物相容性、生物可降解性,以及抗菌、抗感染作用[13],是理想的药物载体材料。然而,由于壳聚糖溶液的高黏度特性,纯壳聚糖静电纺丝具有挑战性[14],因此常与聚氧化乙烯(PEO)等柔性链段聚合物共混,改善其可纺性。尽管如此,壳聚糖基材料仍存在降解速率过快、力学强度不足以及抗菌性能易受多种因素影响,限制了其应用[15-17]。因此,通过将纳米银复合物引入壳聚糖基纳米纤维体系,以提升其生物活性与功能特性。
针对上述问题,本研究采用罗布麻叶提取物绿色合成的纳米银复合物与壳聚糖/聚环氧乙烷(CS/PEO)混合,通过静电纺丝技术制备了AgNPs/CS-PEO纳米复合材料,并对其结构和功能特性进行了评估。
1 材料与方法
1.1 试验原料
罗布麻叶,收集自新疆塔里木地区;芦丁,购自源叶生物;亚硝酸钠、氢氧化钠、甲醇,分析纯,购自GENERAL-REAGENT;硝酸铝、硝酸银,分析纯,购自国药集团化学试剂有限公司;碳酸钠、冰乙酸,分析纯,购自上海凌峰化学试剂有限公司;没食子酸、壳聚糖(脱乙酰度≥95%),购自上海阿拉丁生化科技股份有限公司;聚氧化乙烯、福林酚,购自麦克林;1,1-二苯基-2-三硝基苯肼(DPPH)购自飞净生物;抗坏血酸,分析纯,购自天津市瑞金特化学品有限公司;氯化钠,优级纯,购自国药集团化学试剂有限公司;胰蛋白胨、酵母提取物,购自OXOID;平板计数琼脂,购自青岛海博;所有分离用有机溶剂均为国产分析纯。
1.2 罗布麻叶的提取及制备
收集罗布麻叶植物样品,置于60℃恒温烘箱中干燥48 h,研磨成细粉末状后过筛分离并储存。随后,精确称取1 g样品,加入90%甲醇溶液,于50℃超声提取。提取结束后,合并滤液并浓缩处理,以10000 r/min离心20 min获得上清液液,再经0.22μm微孔滤膜过滤后定容,于4℃保存备用。
1.3 AgNPs的生物合成
制备10 mL 4 mmol/L硝酸银溶液,将40 mg/mL提取物原液稀释至10 mL后与硝酸银溶液混合,于60℃反应100 min。为去除未反应物质及杂质,以10000 r/min离心20 min,弃上清液液后溶解于去离子水中并再次离心,该纯化过程重复3次。最终收集沉淀物,避光条件下干燥24 h,获得纯净干燥的AgNPs粉末,于干燥避光条件下保存备用。
1.4 溶液制备
将4%CS/PEO(7:3)溶解于90%的冰乙酸中,分别加入体积分数为0.25%、0.50%、1%的纳米银溶液,制备含CS、PEO及绿色合成AgNPs的静电纺丝溶液。将溶液置于深棕色瓶中搅拌24 h确保聚合物完全溶解后,超声处理至溶液无气泡,以备静电纺丝使用。
1.5静电纺丝工艺
将铝箔纸固定于纺丝装置接收器,使用5mL的注射器吸取纺丝溶液,将其头端与针头相连,再将高压电源夹头接至金属针头。设定推注速度为0.80 mL/h,电压10 kV,选用G21针头,接收距离为20 cm,启动电源进行静电纺丝。连续纺丝数小时后,将得到的静电纺丝膜在干燥条件下避光保存。
1.6 CS-PEO/AgNPs 纳米复合薄膜的表征
1.6.1扫描电镜表征
采用场发射扫描显微镜(field emission scanning electron microscope,FESEM),观察AgNPs颗粒的形态、尺寸及聚集情况,并通过Image J随机测量100颗银纳米粒子的直径,取平均值。使用扫描电子显微镜(scanning electron microscope,SEM),对制备的纳米纤维膜的微观形貌进行观察,并通过Image J随机测量100根纳米纤维的直径,取平均值。
1.6.2傅里叶红外光谱表征
采用傅里叶变换红外光谱(Fourier transform infrared,FTIR),于4000-400 cm-1的波长范围内表征纳米纤维膜官能团并分析光谱特征。
1.6.3能量色散X射线光谱表征
采用能量色散X射线谱仪(energy dispersive spectrometer,EDS),对AgNPs/CS-PEO纳米纤维膜局部进行截取与放大观察,精确测试表面元素组成,并观察纳米银颗粒在纤维表面的附着状况。
1.6.4孔隙率测定
采用液体置换法测定纳米纤维膜的孔隙率[18]。具体步骤:在5 mL量筒中加入4 mL无水乙醇作为浸润介质,记录该体积(V1);将一定量的纳米纤维膜完全浸入乙醇溶液,静置10 min后,记录无水乙醇和纳米纤维膜的混合体积(V2),此时(V2-V1)代表复合材料固体部分的体积。接着取出湿态膜材料之后,记录剩余乙醇溶液体积(V3)。以材料中所含乙醇的体积(V1-V3)作为材料孔隙所占的体积,则材料的总体积计算公式为:V=(V2-V1)+(V1-V3)=V2-V3。
由式(1)计算材料孔隙率ρ。
1.6.5溶胀率及溶失率测定
采用称重法[19]测定纳米纤维膜吸水率及质量损失率变化。样品在37℃下烘干至恒重,裁剪并记录初始干态质量(mi)。将样品置于PBS缓冲液(pH为7.2~7.4)中浸泡72 h,取出后冲洗并吸干表面水分,再称重(Mw)。接着,将样品真空干燥至恒重,记录样品质量(md)。分别由式(2)和式(3)计算平均溶胀率(W)和平均溶失率(S)。
1.6.6水接触角测定
采用OCA15EC型接触角测量仪对纳米纤维膜进行水接触角测试。将纳米纤维膜裁剪成一定大小平整粘贴于载玻片上,旋转2 mL去离子水滴加在样品表面,观测并记录液滴与膜表面的接触角值。
1.6.7力学性能测试
使用YG(B)026G-500医用纺织品多功能强力仪进行拉伸测试。从待测样品中随机选取5个点,裁成25 mm×5 mm的矩形样片,平整置于夹具中,设置拉伸速度为10 mm/min,隔距为10 mm,进行拉伸试验[20]。
1.6.8体外抗氧化性能测定
根据Bang等[21]的试验方法,采用2,2-二苯基-1-三硝基苯肼(DPPH)自由基清除测定法测量薄膜的DPPH自由基清除活性。具体步骤:称取薄膜样品100 mg,剪碎后泡于10 mL 0.1 mmol/L DPPH溶液中,涡旋1 min后于黑暗室温下反应0.5、1、3和5 h。采用紫外可见分光光度计测定517 nm特征波长处的吸光值,以甲醇溶液作为空白对照。由式(4)计算DPPH自由基清除率。
式中:ADPPH scavenging为DPPH自由基清除率;ADPPH和Afilm分别是对照DPPH溶液和DPPH与样品反应后的吸光度值;
1.6.9透光性能测试
根据Roy等[22]的方法测量样品的光学特性。将待测薄膜裁剪成矩形,并紧密贴合于石英比色血,采用紫外可见分光光度在200~700 nm的波长范围内测量T280nm和T660nm处的透射率。以未放置薄膜的比色皿作为空白对照,评估纳米复合薄膜紫外线阻隔性能和透明度。
1.6.10抗菌性能测试
本试验采用平板菌落计数法评估纳米纤维膜对革兰氏阴性菌(大肠埃希菌,E.coli)和革兰阳性菌(金黄色葡萄球菌,S.aureus)的抗菌活性。将菌液稀释至107 CFU/mL,裁取1 cm×1 cm的纳米纤维膜分别置于5 mL试管中,并向每个试管中加入1 mL菌液。将混合好的5 mL试管放入37℃的恒温培养箱孵育18~24 h。随后将对照样和试样的洗脱液稀释10倍(100μL混合液+900μL PBS缓冲液),以此类推分别稀释至104、103、102、101。从各个稀释液中取50μL进行点板,将固化后的平皿倒置在37℃的环境中培养18~24 h。最后,根据培菌落数(30~300)进行计数和拍照记录,由式(5)计算抑菌率。
式中:C为抑菌率;Ct为对照样接种细菌后培养18~24 h后菌落数:Tt为试样接种细菌后培养18~24 h后菌落数。
1.7统计分析
所有数据均通过Excel进行统计处理,并通过Origin8.5软件进行数据分析与作图。每个试验至少重复3次,结果以“平均值±标准差”表示。
2 结果与分析
2.1 扫描电镜分析
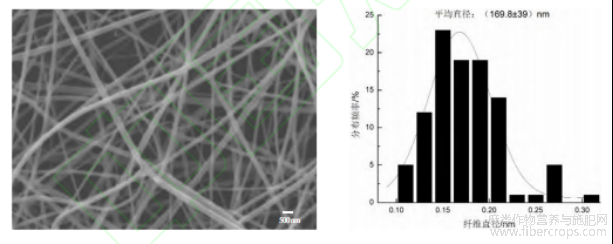
绿色合成的纳米银颗粒的形态特征与粒径分布如图1所示。由罗布麻叶介导合成的AgNPs呈球形结构,颗粒分散性良好,其平均粒径为(71.3±14.5)nm。所制备的纳米纤维膜形态特征与纤维直径分布如图2所示。当壳聚糖与聚氧化乙烷的质量分数为4%,且质量比为7:3的纺丝条件下,所得纳米纤维的平均直径为(169.8±39)nm,纤维直径较均匀,整体形貌良好。
图 1 罗布麻叶提取物介导合成的 AgNPs 的扫描电镜和粒径分布
图 2 CS/PEO 纳米纤维膜 SEM 和直径分布图
2.2 纳米复合薄膜的 FTIR 光谱分析
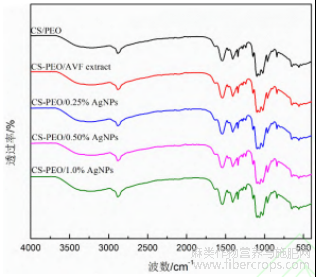
不同质量比纳米纤维膜的傅里叶红外光谱如图 3 所示。结果显示,各组分纳米纤维膜的谱图特征相似,均在 1100 cm-1、1535 cm-1、1651cm-1、2876 cm-1 及 3000~3680 cm-1 处出现显著吸收峰。1100 cm-1 处是由 C—C 和 C—O 的伸缩振动引起的特征吸收峰[23];1340 cm-1 处是 CH3 对称变形特征吸收峰[23];1400、1535、1651cm-1 处为酰胺Ⅰ、Ⅱ、Ⅲ的特征吸收峰[23];2876 cm-1 处为 C—H 伸缩振动吸收峰,表明 CS 与 PE0 之间通过分子间氢键形成物理混合[20]; 3000-3680 cm-1 处宽峰由 O-H、N-H 伸缩振动峰及 CS 分子内氢键协同作用形成[20]。
图 3 AgNPs/CS-PEO 复合纳米纤维膜的红外光谱
2.3 能量色散 X 射线(EDS)分析
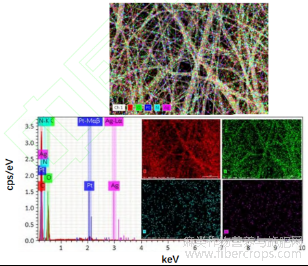
复合纳米纤维膜的能量色散X射线能谱测试结果如图4所示。元素定性分析表明,3 keV处Ag吸收峰与银等离子共振吸收信号相吻合。复合纳米纤维膜主要包含碳、氧、氮、银,其中碳、氧含量较高,这主要由于壳聚糖/聚氧化乙烷主链的C—O结构所致。
图 4 CS-PEO/AgNPs 复合纳米纤维膜 EDS 图谱
2.4 纳米纤维膜的溶胀溶失率及孔隙率测试结果分析
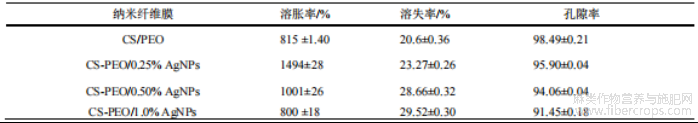
复合纳米纤维膜的溶胀率、溶失率及孔隙率测试结果如表 1 所示。试验结果表明,纳米纤维膜具有较好的溶胀性能,可达自重 800% 至 1494%不等。低浓度时,CS 分子与 AgNPs 形成的致密网络结构限制 PEO 分子的溶出;随 AgNPs 浓度升高,纤维内 AgNPs 数量增多,纳米银与水相互作用增强,孔隙率降低,进而导致溶胀率下降。
表1 不同质量分数AgNPs对复合纳米纤维膜溶胀/溶失率以及孔隙率的影响
2.5 接触角测试
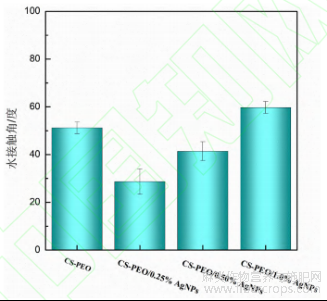
复合纳米纤维膜的水接触角的变化如图 5 所示。结果表明,随纳米银浓度升高,复合膜水接触角较纯 CS/PEO 膜递减,表明 AgNPs 的引入增强了纤维膜亲水性。但当 AgNPs 浓度持续增大时,银颗粒与聚合物的相互作用增强,导致纤维无定形区减少,复合膜亲水性随之下降。
图 5 不同质量分数 AgNPs 对复合纳米纤维膜水接触角的影响
2.6 力学性能测
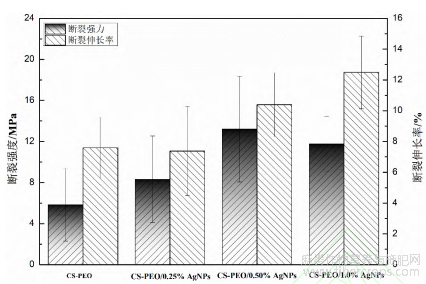
试结果复合纳米纤维膜的拉伸测试结果如图6所示。纯CS/PEO膜拉伸强度为(5.82±3.52)MPa,断裂伸长率为(7.58±1.97)%。引入纳米银后,复合膜拉伸强度升至(13.20±5.14)MPa,伸长率增至12.47%,力学性能显著改善。这是由于AgNPs高结晶度与小粒径特性,使其在聚合物基体中均匀分散,优化了界面相互作用。
图 6 不同质量分数 AgNPs 对复合纳米纤维膜力学性能的影响
2.7 抗氧化性能测试结果分析
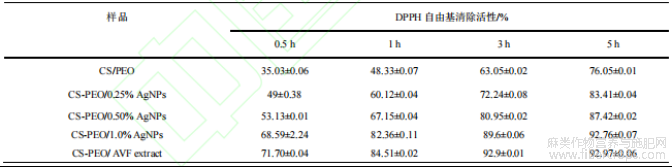
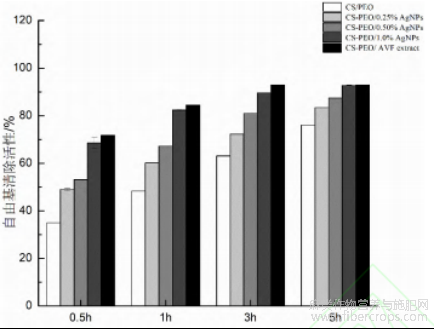
复合纳米纤维膜DPPH自由基清除能力测试结果如表2所示,随AgNPs浓度升高,DPPH自由基清除效果显著增强。含不同浓度AgNPs的复合膜在0.5-5 h内的抗氧化性均优于纯CS/PEO膜。CSPEO/1.0%AgNPs膜反应5h后抗氧化活性达到最高,清除率为92.76%,与CS-PEO/AVF膜相近。这是由于罗布麻叶黄酮类化合物与AgNPs的协同作用,抗氧化性化合物成分附着于AgNPs表面,强化了复合膜的抗氧化效果。综上,CS-PEO/AgNPs复合膜可有效清除活性氧,缓解氧化应激,促进伤口愈合。
表2 不同质量分数AgNPs复合纳米纤维膜的抗氧化性能测定
图 7 含不同质量分数AgNPs复合纳米纤维膜在0.5、1、3和5 h对
DPPH自由基清除活性
2.8 透光率测试结果分析
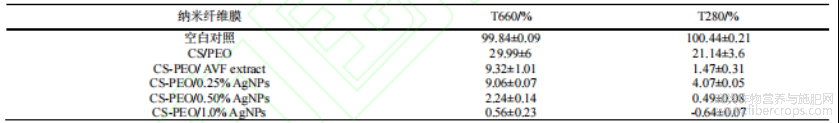
复合纳米纤维膜在660 nm和280 nm波长下的光透射率测试结果如表3所示。随纳米银浓度升高,复合膜在可见光与紫外透光率显著降低。CS-PEO/1.0%AgNPs复合膜透光率分别从29.99%和21.14%降至0.56%和-0.64%,这表明该复合膜具高透明性与强紫外线阻隔性。这是由于分散在基底中的AgNPs附着在纤维表面,通过吸收或反射光线阻碍光透射,显著降低紫外线穿透。该结果与Shankar等[24]报道的AgNPs复合膜光阻隔特性一致。
表3 不同质量分数AgNPs复合纳米纤维膜的透光率测定
2.9 抗菌性能测试结果分析
复合纳米纤维膜的抗菌能力测试结果如表4所示。结果显示,纯CS/PEO膜对两种菌株的抑菌率分别为68.33%和56.00%,尽管壳聚糖分子氨基具备天然抗菌活性但其抗菌强度有限,难以满足临床创面防护要求。CS-PEO/AVF复合膜因含罗布麻叶提取物,抗菌效果有所改善,抑菌率分别达84.33%和82.33%,优于纯CS/PEO膜。这是由于提取物中天然化合物可附着并破坏细菌细胞壁,且与壳聚糖发挥协同抗菌作用。相比之下,含AgNPs的复合纳米纤维膜培养皿无菌落,抗菌活性均超过99.9%,显示出显著抗菌优势。这表明罗布麻叶还原合成的AgNPs大幅增强了复合膜的抗菌性能。
图 8 不同质量比复合纳米纤维膜对大肠埃希菌抗菌活性
图 9 不同质量比复合纳米纤维膜对金黄色葡萄球菌抗菌活性
表4 复合纳米纤维膜的抗菌活性测定
3 结论
本文通过对比TEMPO和4OH-TEMPO体系氧化汉麻纤维前后纤维结构和性能的差异,得出以下结论:TEMPO和4OH-TEMPO在氧化汉麻纤维工艺中均能起到积极有效的作用,经两者氧化后汉麻纤维上非纤维素类物质比例降低,纤维素含量增加,纤维变细,手感变柔软。4OH-TEMPO体系氧化汉麻纤维相对于TEMPO体系更有效。研究结果为联合脱胶方法和获得高品质汉麻纤维、开拓新的应用领域等提供了思路。
本研究以罗布麻叶提取物作为绿色还原剂合成纳米银颗粒(AgNPs),并通过静电纺丝技术将其负载到CS/PEO中,制备AgNPs/CS-PEO纳米纤维膜。试验表明,AgNPs的加入显著改善了薄膜的表面润湿性、力学性能及紫外光阻隔能力;抗氧化测试结果表明,AgNPs/CS-PEO复合膜对DPPH自由基的清除率高达92.76%;抗菌试验结果表明,对金黄色葡萄球菌和大肠埃希菌的抗菌活性均超99.9%。综合评估溶胀率、孔隙率、力学性能、抗氧化性能及抗菌性能,CS-PEO/0.5%AgNPs复合膜因其亲水性、力学性能及抗氧化性能优异,被认为是生物医学和伤口敷料应用的优选材料。综上,AgNPs/CS-PEO复合膜不仅满足医用生物材料的基本性能要求,还兼具抗菌与抗氧化功能,可缓解氧化应激、优化伤口微环境,在促进伤口愈合方面具有潜在临床应用价值。
参考文献
[1]CHEN H L,LAN G Q,RAN L X,et al.A novel wound dressing based on a Konjac glucomannan/silver nanoparticle composite sponge effectively kills bacteria and accelerates wound healing[J].Carbohydrate Polymers,2018,183:70-80.
[2]MA Y H,LIU C Y,QU D,et al.Antibacterial evaluation of sliver nanoparticles synthesized by polysaccharides from Astragalus membranaceus roots[J].Biomedicine&Pharmacotherapy,2017,89:351-357.
[3]ZHOU J,YAO D Y,QIAN Z Y,et al.Bacteria-responsive intelligent wound dressing:Simultaneous in situ detection and inhibition of bacterial infection for accelerated wound healing[J].Biomaterials,2018,161:11-23.
[4]VELÁZQUEZ-VELÁZQUEZ J L,SANTOS-FLORES A,ARAUJO-MELÉNDEZ J,et al.Anti-biofilm and cytotoxicity activity of impregnated dressings with silver nanoparticles[J].Materials Science and Engineering:C,2015,49:604-611.
[5]LI S C,YANG X M,MA H L,et al.Purification,characterization and antitumor activity of polysaccharides extracted from Phellinus igniarius mycelia[J].Carbohydrate Polymers,2015,133:24-30.
[6]曹兴业,谢闰生,赵志远,等.百香果提取液绿色制备银纳米粒子及其抗菌研究[J].食品与发酵工业,2024,50(6):130-137.CAO X Y,XIE R S,ZHAO Z Y,et al.Green preparation of silver nanoparticles from passion fruit extract and their antibacterial research[J].Food and Fermentation Industries,2024,50(6):130-137.
[7]AL MUTAIRI J F,AL-OTIBI F,ALHAJRI H M,et al.Antimicrobial activity of green silver nanoparticles synthesized by different extracts from the leaves of Saudi palm tree(Phoenix dactylifera L.)[J].Molecules,2022,27(10):3113.[PubMed]
[8]XIE W L,LI F J,DING X R,et al.Ethnomedical uses,phytochemistry and pharmacology of Apocynum venetum L[J].Journal of Ethnopharmacology,2025,337:118967.
[9]ABUBAKAR A S,HUANG X Y,BIRHANIE Z M,et al.Phytochemical composition,antioxidant,antibacterial,and enzyme inhibitory activities of various organic extracts from Apocynum hendersonii(hook.f.)woodson[J].Plants,2022,11(15):1964.
[10]GAO G,LIU N,YU C M,et al.UPLC-ESI-MS/MS based characterization of active flavonoids from Apocynum spp.and anti-bacteria assay[J].Antioxidants,2021,10(12):1901.
[11]CASTRO-MAYORGA J L,FABRA M J,CABEDO L,et al.On the use of the electrospinning coating technique to produce antimicrobial polyhydroxyalkanoate materials containing in situ-stabilized silver nanoparticles[J].Nanomaterials,2016,7(1):4.
[12]KARUNAKAR K K,CHERIYAN B V,KRITHIKESHVARAN R,et al.Therapeutic advancements in nanomedicine:The multifaceted roles of silver nanoparticles[J].Biotechnology Notes,2024,5:64-79.
[13]ZHOU F,CUI C J,SUN S B,et al.Electrospun ZnO-loaded chitosan/PCL bilayer membranes with spatially designed structure for accelerated wound healing[J].Carbohydrate Polymers,2022,282:119131.
[14]CAI L,ZHU X Y,RUAN H J,et al.Curcumin-stabilized silver nanoparticles encapsulated in biocompatible electrospun nanofibrous scaffold for sustained eradication of drug-resistant bacteria[J].Journal of Hazardous Materials,2023,452:131290.
[15]DENG A P,KANG X,ZHANG J,et al.Enhanced gelation of chitosan/β-sodium glycerophosphate thermosensitive hydrogel with sodium bicarbonate and biocompatibility evaluated[J].Materials Science and Engineering:C,2017,78:1147-1154.
[16]ASIABI M,MEHDINIA A,JABBARI A.Electrospun biocompatible Chitosan/MIL-101(Fe)composite nanofibers for solid-phase extraction ofΔ9-tetrahydrocannabinol in whole blood samples using Box-Behnken experimental design[J].Journal of Chromatography A,2017,1479:71-80.
[17]边瑞琦,王利君,熊杰.Genipin交联丝素蛋白纳米纤维膜的制备与性能[J].复合材料学报,2013,30(2):83-88.BIAN R Q,WANG L J,XIONG J.Preparation and properties of Genipin cross-linked silk fibroin nanofibrous membranes[J].Acta Materiae Compositae Sinica,2013,30(2):83-88.
[18]周香香.壳聚糖基含银纳米纤维的制备及性能研究[D].上海:东华大学,2016.ZHOU X X.Fabrication and performance research of chitosan nanofibers contained with silver nanoparticles[D].Shanghai:Donghua University,2016.
[19]辛宜聪,于嘉伦,徐丹.纳米银/壳聚糖复合膜的制备及性能[J].包装工程,2017,38(19):20-24.XIN Y C,YU JL,XU D.Preparation and performance of nano-silver/chitosan composite films[J].Packaging Engineering,2017,38(19):20-24.
[20]程凤.载药抗菌创伤敷料的制备与性能研究[D].上海:东华大学,2015.CHENG F.Study on preparation and properties of antimicrobial drug loaded wound dressing[D].Shanghai:Donghua University,2015.
[21]BANG Y J,SHANKAR S,RHIM J W.In situ synthesis of multi-functional gelatin/resorcinol/silver nanoparticles composite films[J].Food Packaging and Shelf Life,2019,22:100399.
[22]ROY S,SHANKAR S,RHIM J W.Melanin-mediated synthesis of silver nanoparticle and its use for the preparation of carrageenan-based antibacterial films[J].Food Hydrocolloids,2019,88:237-246.
[23]KOHSARI I,SHARIATINIA Z,POURMORTAZAVI S M.Antibacterial electrospun chitosan–polyethylene oxide nanocomposite mats containing bioactive silver nanoparticles[J].Carbohydrate Polymers,2016,140:287-298.
[24]SHANKAR S,TANOMROD N,RAWDKUEN S,et al.Preparation of pectin/silver nanoparticles composite films with UV-light barrier and properties[J].International Journal of Biological Macromolecules,2016,92:842-849.
文章摘自:夏克尔·赛塔尔,祖力米热·艾尔肯,高晶,等.罗布麻叶提取物介导绿色合成AgNPs/CS-PEO复合纳米纤维膜的抗菌抗氧化性能[J/OL].东华大学学报(自然科学版),1-13[2025-06-08].https://doi.org/10.19886/j.cnki.dhdz.2024.0413.