摘 要: 为探究苎麻内生细菌对苎麻田间生长的影响,试验从苎麻茎中分离了一株巨大芽孢杆菌,在大田中对苎麻进行灌根,设置巨大芽孢杆菌液(C1)和LB(Luria-Bertani)液体培养基CK)两种处理,在第一次处理苎麻50d后,收获并测量其植株的农艺性状、生理指标以及土壤的营养元素和酶活等指标,分析外施内生细菌对大田苎麻生长的影响。结果表明,巨大芽孢杆菌C1能显著提高苎麻的株高、茎粗、皮鲜重和皮干重,相较于CK,C1处理的土壤中性磷酸酶活性提升,脲酶活性下降,关联分析显示两种酶活性与苎麻产量显著相关。土壤氮磷钾元素的变化也表现出C1处理的苎麻有更强的吸收土壤养分的能力。苎麻内生巨大芽孢杆菌可以较好的促进苎麻生长,试验结果有望为苎麻内生菌的开发利用,推动苎麻产业发展奠定理论基础。
关键词:苎麻;内生细菌;促生
苎麻(Boehmeria nivea(L.)Gaudich.)为荨麻科苎麻属多年生宿根植物,是重要的纤维作物,其纤维强度较高,纺织出的面料具有抗菌、防腐、透气等特性[1],苎麻纺织物经特殊处理后还可以作为阻燃材料[2]。苎麻纤维具有高度相容性,可以作为优良的医学缝合材料[3]。苎麻根部可入药,具有清热、安胎、凉血和止血等作用[4]。苎麻茎叶富含蛋白,在家兔、山羊、鹅和猪等动物[6-8]饲养中作为饲料原料或青贮饲料使用,可以提升禽畜的品质和产量。虽然,苎麻具有较高的经济和应用价值,但在其栽培过程中需要大量的肥料以维持苎麻的生长,同时经常出现的旱涝灾害造成了苎麻减产,所以,提高苎麻的肥料利用率以及抗逆能力是其生产中的一项重要挑战。
植物中的部分内生细菌或真菌具有促生长、抗虫、抗病和辅助植物抵御非生物胁迫的效用。内生真菌通常与植物结合形成菌根,如丛枝根菌、兰花菌根和杜鹃菌根[9]等,形成的菌根辅助植物吸收水分和营养,有的菌根还会在植物之间传递信号[10]。研究较多的内生细菌有根瘤菌、芽孢杆菌和假单胞菌等,这些内生细菌在薰衣草、油菜、辣椒和茄子等园艺作物[11-13]上有所应用且都取得了积极效果。在粮食作物中有益内生细菌多集中在促生和抗胁迫方面的研究,如内生菌对玉米的肥料吸收及产量的影响[14],水稻的抗病虫害过程中内生菌起到的调控作用[15-16]和内生菌对小麦种子发芽率的影响[17]。对植物内生菌的研究及开发也是农业可持续发展的重点之一,合理的应用微生物菌肥可以节约肥料同时提升农产品品质[18-19]。苎麻内生菌相关的研究主要有拮抗病原菌的生防菌筛选[20],帮助苎麻修复镉污染的土壤[21]以及对苎麻根部内生菌的筛选和鉴定[22]等,但是内生细菌在苎麻田间生产方面的应用研究较少。大田环境较为复杂且不可控因素较多,对大田中栽培的苎麻进行直接处理可以得到更接近实际生产的效果。所以,本研究以主栽品种“中苎1号”为对象,在大田中使用从苎麻茎中筛选到的1株巨大芽孢杆菌对其进行处理,探究内生菌对苎麻田间生长的影响,为开发苎麻的有益内生菌提供依据。
1 材料与方法
1.1 试验地点
试验地点为中国农业科学院麻类研究所白箬铺试验基地。
1.2 试验材料
1.2.1 苎麻
选用试验基地苎麻田中的“中苎1号”麻蔸。该麻蔸是收获第二季麻7d后的麻蔸,由扦插苗发育而来。
1.2.2 供试菌株及培养条件
从苎麻茎部分离出1株内生细菌,前期经测序鉴定后,确定为巨大芽孢杆菌,用LB液体培养基(酵母提取物5g/L、氯化钠10g/L、胰蛋白胨10g/L)32℃培养48h,备用。
1.3 试验方法
1.3.1 巨大芽孢杆菌促生能力检验
将菌液分别滴加到解有机磷、解无机磷和产铁载体的验证平板上,验证细菌对营养元素的利用能力[23-24]。将菌液12000r/min,10min离心取上清,用Salkowskis比色液与上清液2:1测试细菌产IAA能力[25]。
1.3.2 巨大芽孢杆菌的田间处理试验设计
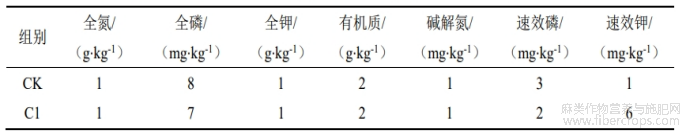
将菌株接种到LB液体培养基中,32℃培养48h后用LB液体培养基将菌液浓度调到OD600=1.0。设置C1(巨大芽孢杆菌)和CK(无菌LB液体培养基)两个处理,每个处理3个重复,每个重复5篼苎麻。在每蔸苎麻旁浇灌300mL菌液或300mL无菌LB液体培养基。自第一次处理后隔7d再处理一次,自第一次处理50d后苎麻基本完成第三季的生长,收获苎麻地上部并采集地下5cm处土壤,以备后续试验。土壤理化性质测定方法参考土壤农化分析[26],其中,土壤全氮采用凯氏定氮法、全磷采用钼锑抗比色法、全钾采用火焰光度法、有机质采用外加热法、碱解氮采用碱解扩散法、速效磷采用碳酸氢钠浸提-钼锑抗比色法、速效钾采用醋酸铵浸提结合火焰光度法进行测定。
1.3.3 植株生理、产量和土壤酶活性指标测定
试验完成后,取苎麻地上部,测量其株高和茎粗,将苎麻皮剥去后测量其皮厚,并称鲜重,晒干后称其干重,除以每组苎麻的分枝数得到平均干重和鲜重。取苎麻生长点嫩叶用试剂盒(索莱宝,中国)测超氧化物歧化酶(SOD)和过氧化物酶(POD)活性、丙二醛(MDA)和可溶性糖含量。取地下5cm处土壤过筛风干后,用pH计测土壤pH值,用试剂盒(格锐思,中国)测土壤中性磷酸酶(S-NP)、蔗糖酶(S-SC)、脲酶(S-UE)和过氧化氢酶(S-CAT)活性。
1.4 数据处理
采用SPSS、GraphPad Prism8和Excel进行数据和图像处理,LSD法进行比较分析。使用Genes Cloud网站(https://www.genescloud.cn)绘制关联热图。
2 结果与分析
2.1 菌株促生能力检验
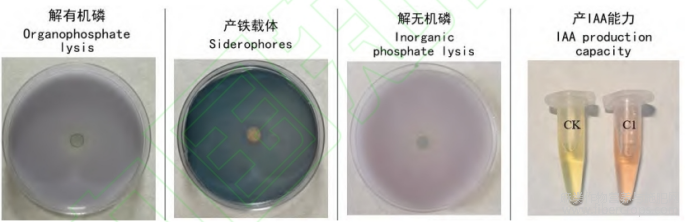
将C1接种到解有机磷固体培养基、解无机磷固体培养基和产铁载体培养基上,发现C1菌具有溶有机磷和无机磷及产铁载体的功能。菌液上清经过和Salkowskis比色液反应后呈现红色表示C1还具有产IAA能力(图1)。
图1 巨大芽孢杆菌(C1)促生特性检测
注:菌液在对应的培养基上发生相应的颜色变化表示菌株具有相应的能力,显示液出现红色表明菌株具有产IAA能力。
2.2 苎麻农艺性状及生理指标
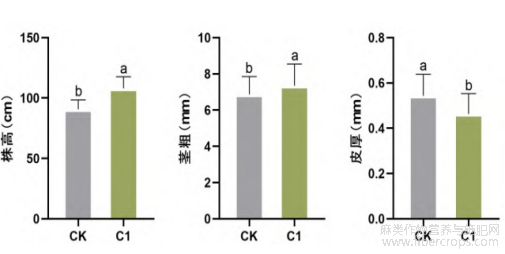
测量了苎麻的株高、茎粗和皮厚发现,C1处理可以显著提高苎麻的株高和茎粗。C1处理的苎麻株高平均值为110.50cm,较CK处理的平均株高90.71cm提高了21.82%。C1处理的平均茎粗为7.23mm,较CK处理的6.86mm提升了5.39%。但是,C1处理的苎麻麻皮变薄,相较于CK处理的平均皮厚0.54mm,C1处理的平均皮厚为0.46mm,较CK降低了17.39%(图2)。
图2 C1 处理对苎麻株高、茎粗和皮厚的影响
注:图中数值表示平均值±标准偏差,不同的字母代表不同处理间差异显著(LSD,p < 0.05)。
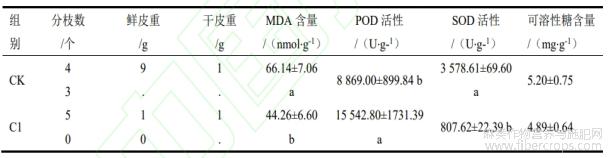
苎麻的经济产品是麻皮,测量了收获后的苎麻分枝数和麻皮重量发现,C1处理的苎麻平均分枝数较CK多出7个,且鲜皮重和干重均高于CK,以干重来看,C1处理提高了约18.97%的重量。苎麻叶片可溶性糖积累量没有显著差异,但是两组处理的抗氧化酶活性有较为明显的差异,C1处理后苎麻POD活性显著高于CK,而SOD活性显著低于CK,CK的MDA含量显著高于CK“(表1),C1处理的苎麻MDA显著低于CK,表明C1处理的苎麻膜损伤程度低于CK。
表1 C1处理对苎麻生理指标及产量的影响
注:表中数值表示平均值±标准差,同列不同的字母代表不同处理间差异显著(LSD,p < 0.05)。
2.3 土壤 pH、酶活性及理化性质指标
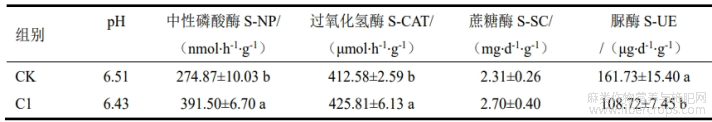
CK处理的土壤pH为6.51,C1处理的土壤pH为6.43,C1处理组较CK组土壤pH略低。酶活性的结果显示,C1处理的土壤中性磷酸酶和过氧化物酶的活性显著高出CK,而土壤的脲酶活性显著低于CK,两组土壤的蔗糖酶活性无显著差异。
表2 C1对苎麻栽培土壤酶活性的影响
注:表中数值表示平均数±标准差,同列不同字母代表不同处理间差异显著(LSD,p<0.05)。
C1处理的苎麻根际土壤的全氮、全磷、碱解氮、速效磷、速效钾和有机质含量均显著低于CK,土壤的全钾含量未出现显著变化(表3)。其中,变化幅度最大的是速效钾,C1处理的较CK降低了54.28%。
表3 C1处理对苎麻根际土壤理化性质的影响
注:表中数值表示平均值±标准差,不同字母代表不同处理间差异显著(LSD,p<0.05)。
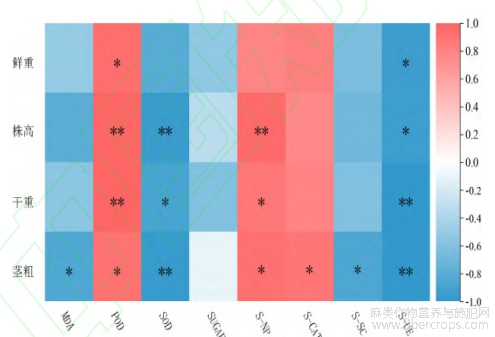
2.4 苎麻农艺性状与生理指标、土壤指标的关联分析
将苎麻农艺性状与土壤酶活、植株生理指标进行关联分析,POD和S-NP与农艺性状有较为明显的正相关,而SOD和S-UE与农艺性状有显著负相关。农艺性状中的茎粗与除可溶性糖以外的指标均有显著相关,同时,可溶性糖这一指标与所有农艺性状没有显著相关。在所有指标中,POD、SOD、S-NP和S-UE是较为重要的指标。
图3 苎麻农艺性状与生理指标及土壤酶活性关联分析
注:“*”表示p<0.05,“**”表示p<0.01。
3 讨论
本试验前期在苎麻茎中分离到1株巨大芽孢杆菌,具有产IAA、解磷和固氮等功能,将其处理苎麻后,苎麻的鲜重和干重均有显著提升,分枝数也较CK有一定提升但未达到显著差异。巨大芽孢杆菌在其他作物中有较多报道,如在小麦研究中,巨大芽孢杆菌的添加可以提高小麦的发芽率和产量[27-28];向日葵种子经芽孢杆菌处理后,生长出更长的根长和更大的叶片[29]。在苹果生产中,巨大芽孢杆菌的添加提升了苹果的品质和栽种苹果土壤的速效磷、速效钾含量[30]。由此看来,巨大芽孢杆菌是一种广泛存在于植物体内的有益内生菌。
在大田试验中,巨大芽孢杆菌菌液处理的苎麻表现出较高的POD活性和较低的SOD活性及MDA含量,SOD将超氧阴离子自由基歧化生成氧和过氧化氢,POD则是清除过氧化氢,这两个酶同属抗氧化酶,起到清除活性氧和自由基的作用,过量的活性氧和自由基会损害质膜积累MDA,而施加巨大芽孢杆菌的苎麻则出现SOD活性下降、POD活性上升的现象,从MDA含量来看,巨大芽孢杆菌处理减小了苎麻细胞膜的损伤。施加巨大芽孢杆菌缓解胁迫的情况同样也发生在花生、景天和棉花等作物上[31-33],番茄的研究中也发现巨大芽孢杆菌可以提升番茄的防御酶活性[34]。
关于巨大芽孢杆菌与植物互作机制的研究也有一些报道,Zhang等[35]给狼尾草接种巨大芽孢杆菌后,发现狼尾草中大多数与光合作用相关的蛋白被上调。Mehtab等[36]发现巨大芽孢杆菌会促进羽扇豆根部释放磷酸酶从而提升植物获取磷的能力。苎麻的产量主要由茎纤维决定,这就意味着高的苎麻产量需要更长的株高、更粗的茎粗和更多的纤维含量,巨大芽孢杆菌的施加可能导致植株对土壤营养元素吸收能力的变化,从而让苎麻更好的进行营养生长。施菌处理后土壤中性磷酸酶和脲酶活性出现差异,土壤磷酸酶的作用是将土壤中的有机磷矿化为无机态,从而供作物吸收,巨大芽孢杆菌具有解有机磷的功能,推测巨大芽孢杆菌的添加是土壤磷酸酶活性提升的直接原因,在上文羽扇豆的研究[36]中提到,巨大芽孢杆菌的添加可以提高植物酸性磷酸酶的表达量从而促进根鞘获取磷的能力。在苎麻根际土壤中全磷和速效磷的含量显著降低,推测施菌处理提升了苎麻对土壤中磷元素的吸收能力。巨大芽孢杆菌处理的苎麻土壤的脲酶活性显著低于CK,脲酶是对尿素转化起关键作用的酶,脲酶通过酶促反应为植物提供可利用的氮源,在不同区域土壤酶活性的研究中发现,土壤脲酶与土壤氮素含量呈正相关[37-38]。苎麻是一种高蛋白含量的作物[39],在苎麻选育过程中通常将株高作为重点选择指标。苎麻显著提升的株高和茎粗意味着苎麻需要从土壤中吸收更多的营养元素,尤其是氮素,这可能是土壤脲酶活性下降的原因之一;另一方面,脲酶活性的下降意味着尿素分解速度的下降[40],植物需要更长时间的获取氮元素并提高氮素的利用率,在关联分析中,脲酶活性与苎麻产量呈显著负相关,苎麻根际土壤中的氮素下降也说明施菌调动了苎麻对氮元素的吸收。除了氮和磷外,巨大芽孢杆菌处理的苎麻根际土壤中的有机质和速效钾含量也低于CK,说明施菌处理的苎麻对碳源和钾元素的利用能力也有提升。在整个试验过程中没有施加肥料,施菌处理的土壤中各种酶的活性和较低的肥力,巨大芽孢杆菌促进了苎麻对营养元素的吸收。在施加巨大芽孢杆菌后,对苎麻的生理指标和产量产生了积极影响,但是值得注意的是施菌处理的苎麻茎皮变薄,茎皮厚度在一定程度上会影响苎麻最终产量,解决茎皮变薄也是后续研究需要关注的问题。
4 结论
本研究用苎麻体内分离的1株促生巨大芽孢杆菌,通过大田试验验证其有提高苎麻产量和提高苎麻抗氧化的能力,并且还可以调整土壤酶系统和促进苎麻吸收土壤中的营养元素。这为苎麻促生菌的开发提供了资源和依据,也有利于推进苎麻绿色种植。
参考文献
[1] 杨洁,唐昀,申香英,等.我国苎麻产业现状与振兴发展[J].中国麻业科学,2022,44(4):253-256.
[2] Khalili P, Blinzler B, Kádár R, et al. Ramie fabric Elium® composites with flame retardant coating: Flammability, smoke, viscoelastic and mechanical properties[J]. Composites Part A: Applied Science and Manufacturing, 2020, 137: 105986.
[3] Kandimalla R, Kalita S, Choudhury B, et al. Fiber from ramie plant(Boehmeria nivea): a novel suture biomaterial[J]. Materials Science and Engineering: C, 2016, 62: 816-822.
[4] 索晓梅,孙婉萍,谢明.苎麻根本草考证[J].亚太传统医药,2024,20(3):182-188.
[5] 彭连共,陈珏.苎麻根的生药学鉴定研究[J].中外医疗,2021,40(23):83-85.
[6] 梅秀丽,甘伟,任小松,等.饲用苎麻粉对母兔繁殖性能的影响[J].中国畜牧杂志,2022,58(1):162-166.
[7] 孙盛楠,林谦,向海,等.不同长度的饲用苎麻青贮对黑山羊瘤胃发酵参数及纤维素酶活性的影响[J].动物营养学报,2019,31(1):477-484.
[8] 邓荟芬.饲用苎麻木质纤维素生物降解及其产物对育肥猪肉质的调控[D].长沙:湖南农业大学,2021.
[9] Genre A, Lanfranco L, Perotto S, et al. Unique and common traits in mycorrhizal symbioses[J]. Nature Reviews Microbiology, 2020, 18(11): 649-660.
[10] Saikkonen K, Wäli P, Helander M, et al. Evolution of endophyte–plant symbioses[J]. Trends in Plant Science, 2004, 9(6): 275-280.
[11] 赵妍妍,林彬,玛依拉·吐尔地别克,等.薰衣草根际促生菌ACC脱氨酶基因克隆与表达[J].工业微生物,2024,54(4):161-163.
[12] 司春灿,林英,尚天玉.油茶根际促生菌的筛选与促生特性[J].中南林业科技大学学报,2024,44(4):28-35.
[13] 张锋,张顺顺,尚庆茂.根际促生菌对茄子?南瓜?辣椒穴盘苗胚轴和根际微生物多样性的影响[J].蔬菜,2024(9):39-49.
[14] Gabriela C A, Santos Carlos L R D, Jerri E Z, et al. Agronomic evaluation of Herbaspirillum seropedicae strain ZAE94 as an inoculant to improve maize yield in Brazil[J]. Pedosphere, 2021, 31(4): 583-595.
[15] BING X L, ZHAO D S, PENG C W, et al. Similarities and spatial variations of bacterial and fungal communities in field rice planthopper(Hemiptera: Delphacidae) populations[J].Insect Science, 2020, 27(5):947-963.
[16] WANG X, HE S W, HE Q, et al. Early inoculation of an endophyte alters the assembly of bacterial communities across rice plant growth stages[J]. Microbiology Spectrum, 2023, 11(5): e0497822.
[17] REN Z Y, CHEN A J, ZONG Q Q, et al. Microbiome signature of endophytes in wheat seed response to wheat dwarf bunt caused by Tilletia controversa Kühn[J]. Microbiology Spectrum, 2023, 11(1): e0039022.
[18] 曹际钊,都晓伟,李倩,等.药用植物内生菌促药效成分生物合成的研究进展[J].中南药学,2024,22(2):445-452.
[19] 陈招荣,刘新悦,赵欣迪,等.植物内生菌群落组成及其功能研究进展[J].生命科学,2023,35(2):132-139.
[20] 孙向平,陈梦雅,张梦君,等.1株苎麻生防内生细菌的分离鉴定及抑菌能力[J].江苏农业科学,2019,47(2):87-90.
[21] 向书琴,胡春玉,黄宝兰,等.内生细菌在镉胁迫下对苎麻幼苗生理生化特性的影响[J].智慧农业导刊,2023,3(6):22-25.
[22] 杨琦,刘淳劼,郭兵,等.苎麻根部内生细菌的分离鉴定及促生潜力评价[J].中国麻业科学,2020,42(5):219-226.
[23] NAUTIYAL C S. An efficient microbiological growth medium for screening phosphate solubilizing microorganisms[J]. FEMS Microbiology Letters, 1999, 170(1): 265-270.
[24] Schwyn B, Neilands J B. Universal chemical assay for the detection and determination of siderophores[J]. Analytical Biochemistry, 1987, 160(1): 47-56.
[25] Glickmann E, Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied and Environmental Microbiology, 1995, 61(2): 793-796.
[26] 鲍士旦.土壤农化分析[M].3版.北京:中国农业出版社,2000.
[27] 殷小冬,李其胜,贾艳艳,等.一株巨大芽孢杆菌的促生特性及其对小麦种子发芽的影响[J].南方农业,2023,17(2):208-210.
[28] Ait Bessai S, Cruz J, Carril P, et al. The plant growth-promoting potential of halotolerant bacteria is not phylogenetically determined: evidence from two Bacillus megaterium strains isolated from saline soils used to grow wheat[J]. Microorganisms, 2023, 11(7): 1687.
[29] Shvets Y A, Krylova K D, Limanska N V. Effect of Bacillus megaterium onu 500 on the germination and growth of sunflower seedlings[J]. Microbiology&Biotechnology, 2021, 1(51): 45-54.
[30] 潘纪源,董庆龙,温海彬,等.巨大芽孢杆菌菌剂对苹果产量?品质及土壤微生物的影响[J].园艺学报,2023,50(11):2453-2465.
[31] 山东省花生研究所.一株巨大芽孢杆菌SPDONG-4及其在花生抗逆节肥促生中的应用:CN202410636944.1[P].2024-09-06..
[32] 邓月强,曹雪莹,谭长银,等.巨大芽孢杆菌对伴矿景天修复镉污染农田土壤的强化作用[J].应用生态学报,2020,31(9):3111-3118.
[33] Bataeva Y, Magzanova D, Baimukhambetova A, et al. Influence of Bacillus megaterium to promote growing of cotton (Gossypium Hirsutum L.). The Caspian in the Digital Age. Dela Press Publishing House, 2022: 6.
[34] 姚起,宋国栋,乔康.巨大芽孢杆菌TA-4的筛选鉴定及对番茄防御酶活性的影响[J].生物灾害科学,2024,47(1):42-49.
[35] ZHANG W H, HE L Y, WANG Q, et al. Inoculation with endophytic Bacillus megaterium 1Y31 increases Mn accumulation and induces the growth and energy metabolism-related differentially-expressed proteome in Mn hyperaccumulator hybrid Pennisetum[J]. Journal of Hazardous Materials, 2015, 300: 513-521.
[36] Aslam M M, Pueyo J J, Pang J Y, et al. Root acid phosphatases and rhizobacteria synergistically enhance white lupin and rice phosphorus acquisition[J]. Plant Physiology, 2022, 190(4): 2449-2465.
[37] 董齐琪,王海燕,杜雪,等.东北低山区典型林分类型土壤脲酶活性特征[J].应用与环境生物学报,2023,29(3):690-695.
[38] 杨值,李小英,袁勇,等.滇南典型季风常绿阔叶林土壤脲酶特征及其影响因子[J].林业资源管理,2023(4):71-79.
[39] 陈继康,谭龙涛,喻春明,等.不同苎麻基因型氮素累积与利用效率差异分析[J].中国麻业科学,2017,39(1):30-36.
[40] 李佳旺,徐嘉,于航,等.土壤脲酶酶促反应对3种有机氮肥施用的响应[J].中国生态农业学报,2024,32(6):1033-1042.
文章摘自:李广,王梓涵,王鑫,朱四元.外施苎麻内生细菌对大田苎麻生长的影响[J/OL].中国麻业科学.https://link.cnki.net/urlid/43.1467.S.20250320.0852.002。