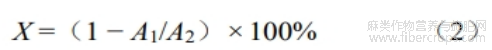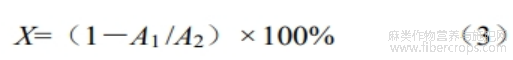摘 要: 以罗布麻叶为原料,接种黑曲霉进行发酵,对发酵后的样品进行冻干处理,测定其氨基酸、蛋白质和还原糖含量,分析主要酚类物质的变化及抗氧化活性。结果表明,发酵的前6天氨基酸及蛋白质含量无显著变化,但到12天时粗蛋白含量上升而氨基酸含量下降,还原糖含量在整个发酵过程中持续降低。发酵6天后主要酚类物质总量显著上升(p<0.05),与未发酵相比提高了8.58%,绿原酸、芦丁和紫云英苷含量在发酵过程中呈先上升后下降趋势,而咖啡酸和槲皮素含量呈一直上升趋势。发酵第6天时DPPH与ABTS+自由基清除率比未发酵样品分别提高了18.90%和14.78%。总体来看,发酵6天对罗布麻叶的总蛋白及氨基酸总量无显著影响,但显著提高了其主要酚类物质的总量及抗氧化能力。
关键词: 罗布麻叶;黑曲霉;营养成分;微生物发酵
罗布麻(Apocynum venetum L.)是一种多年生宿根草本植物,隶属于夹竹桃科罗布麻属,主要分布在中国的辽宁、吉林、山西、陕西、新疆等地区。据报道,新疆吾尔自治区巴音郭楞蒙古自治州尉犁县的罗布麻资源高达53.33万hm2[1]。罗布麻作为纤维作物,目前主要运用于纺织[2-3],这限制了其资源的利用。罗布麻叶是罗布麻的干燥叶,常被用作茶饮,是一种历史悠久的中草药。据《中华人民共和国药典》的记载[4],罗布麻叶具有“清热利水,平肝安神”等功效,广泛用于高血压、头晕、心悸、失眠、高血脂、神经衰弱及浮肿尿少等治疗。随着现代药理学的深入研究表明,罗布麻叶中含有包括槲皮素、异槲皮苷、芦丁、金丝桃苷等活性成分,且富含氨基酸、多糖等营养物质[5-7],是良好的药食同源产品开发的资源。罗布麻因其丰富的营养价值及显著的高血压治疗效果正受到越来越多的关注。
微生物发酵具有改善产品风味的作用,是提高产品营养价值和保健功能的有效方法之一。崔艺燕等[8]利用康宁木霉固态发酵茶渣,提高了茶渣中多种游离氨基酸含量和必需氨基酸/总氨基酸比值。刘艳等[9]通过混菌固态发酵辣木叶,发现发酵后的辣木叶粗蛋白、多肽、总氨基酸、必需氨基酸、鲜味氨基酸分别增加了21.02%、83.81%、17.57%、15.28%和8.16%。ZUO等[10]在研究红苹果酒酿造过程中营养物质变化发现,发酵过程中虽然16种氨基酸的种类和含量出现了下降,但在发酵第8天利用酵母菌发酵可以使糖彻底转化为醇,保留更多的营养成分。Okafor等[11]测定了发酵前后玉米和鹰嘴豆营养成分变化,结果发现,发酵提高了样品中蛋白质含量,且其赖氨酸、色氨酸、异亮氨酸、苯丙氨酸含量均得到了提高。Song等[12]利用桑黄菌发酵燕麦、大麦、小米、大米、荞麦、玉米和薏苡仁,发酵后粗蛋白、可溶性蛋白含量显著增加。在燕麦发酵中,总多酚含量提高了6.23mg QE/g,总黄酮含量提高了21.8mg Rutin/g,且抗氧化能力均得到了提升。顾秋亚等[13]通过金花菌发酵沙棘叶,显著提高了沙棘叶的总黄酮含量及其抗氧化活性。但目前关于罗布麻发酵的研究主要集中在生物脱胶[14-15],对其发酵后营养成分变化及抗氧化能力变化的研究较少。黑曲霉(Aspergillus niger)能够分泌酯酶、糖苷酶、羟化酶等在内的多种酶[16-17],这些酶在发酵过程中能诱导化学成分发生羟基化、脱羟基、甲基化、脱甲基、去糖基化等一系列反应,进而生成具有新结构的化合物或中间体,在生产上备受瞩目。因此,本研究采用黑曲霉固态发酵法对罗布麻叶进行发酵,研究发酵不同时间的罗布麻叶营养成分及抗氧化能力的变化及主要酚类物质含量的变化,为罗布麻资源利用提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 罗布麻叶与黑曲霉
罗布麻叶于2023年采自福建省南安市罗浮山。自然风干后,再在60℃下烘干2h,粉碎过40目筛,备用。黑曲霉(CGMCC5.0809)来源于中国普通微生物菌种保藏中心。
1.1.2 化学试剂
马铃薯葡萄糖琼脂培养基购自杭州百思生物技术有限公司。
无水葡萄糖、DPPH、硫酸亚铁、过二硫酸钾、铁氰化钾等试剂,均为分析纯,购自国药集团化学试剂有限公司。
1.2 仪器与设备
LC16series液相色谱,日本Shimadzu公司。S7130型氨基酸分析仪,德国Sykam公司。K1100F型全自动凯氏定氮仪,中国山东海能科学仪器有限公司。Multiskan GO 1510型酶标仪,美国Thermo Fisher Scientific公司。SW-CJ-1F型超净工作台,中国苏州净化设备有限公司。SPX-250B型恒温培养箱,中国上海知楚仪器有限公司。
1.3 方法
1.3.1 试验方法
(1)黑曲霉孢子准备
将黑曲霉接种于马铃薯葡萄糖琼脂培养基后,在28℃下培养7d备用。利用无菌水冲洗培养基表面的黑曲霉孢子并转移至三角锥瓶中,取部分黑曲霉孢子利用血球板进行计数,并调整溶液孢子浓度为1Í106个/mL,备用。
(2)罗布麻叶固态发酵及样品准备
将罗布麻叶粉碎后在121℃条件下进行高压蒸汽灭菌15min。称取3g灭菌后的罗布麻叶平铺于培养皿中,加入5mL无菌水,吸取2mL黑曲霉孢子悬浮液接种到平板对罗布麻叶进行固态发酵,对照样品加入2mL无菌水,发酵温度28℃,发酵时间分别为3、6、9、12d。发酵后进行冷冻干燥处理,称取1g冷冻干燥粉末,加入20mL70%乙醇,于40℃、500W条件下超声30min,重复2次,离心后合并滤液,于4℃保存。
1.3.2 分析检测
(1)还原糖含量测定
参照李秀清等[18]方法进行测定,以葡萄糖浓度(μg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线, 根据标准曲线求得样品中还原糖含量。样品还原糖含量计算公式为:
式中:X—还原糖含量,mg/g;c—样品中还原糖浓度,μg/mL;t—稀释倍数;m—罗布麻叶粉末质量,g;V—样品体积,mL。
(2)蛋白质含量测定
蛋白质含量采用全自动凯氏定氮仪测定。取0.5g样品,放入消化管中加入凯氏定氮片及浓硫酸10mL,在400℃下消化3h,加入强碱进行蒸馏使氮气逸出,用硼酸进行吸收后酸滴定,测出氮含量,最终乘以换算系数6.25计算粗蛋白含量。
(3)氨基酸含量测定
氨基酸含量测定参照GB5009.124—2016《食品安全国家标准食品中氨基酸的测定》,采用全自动氨基酸分析仪SykamS7130测定发酵前后游离氨基酸含量。
(4)酚类物质含量测定
供试品:称取罗布麻叶粉末1g,置于50mL离心管中,以1:20比例加入70%乙醇,在45℃、500W条件下超声辅助提取30min,离心取上清,重复2次,合并所得滤液,过0.45μm微孔滤膜即得。
对照品:分别精密称取对照品绿原酸、咖啡酸、芦丁、槲皮素、金丝桃苷、木犀草苷、紫云英苷置于量瓶中,甲醇定容至刻度,得到浓度分别为333.33μg/mL绿原酸、500.00μg/mL咖啡酸、500.00μg/mL芦丁、342.60μg/mL槲皮素、129.63μg/mL金丝桃苷、533.33μg/mL木犀草苷、566.67μg/mL紫云英苷的标准对照溶液,在4℃下保存。
色谱条件:C18色谱柱(4.6mm×250mm,5μm);流动相乙腈(A)-0.2%磷酸水(B),梯度程序,0~8min,5%A~12%A;8~20min,12%A~18%A;20~45min,18%A~25%A;45~50min,25%A~35%A;50~52min,35%A~5%A;52~57min,5%A;柱温35℃;体积流量0.8mL/min;进样量10μL,检验波长256nm。
(5)抗氧化能力测定
DPPH自由基清除率:参考Williams等[19]的方法略有修改,在1mL样品中加入1mL的DPPH(0.2mmol/L)与1mL样液,以等量无水乙醇作为空白对照,在室温下黑暗反应30min,在517nm处测量反应溶液的吸光度。吸光度越低,DPPH自由基清除能力越强。自由基清除率计算公式如下:
式中:X—DPPH自由基清除率,%;A1—样品在517nm下吸光度值;A2—空白组在517nm下吸光度值。
ABTS自由基清除率:参考Re等[20]方法略有修改,取7.4mmol/LABTS原液与2.6mmol/L过硫酸钾各5mL,在室温下静置12~16h后使用。在检测前,将原液用95%乙醇稀释,使其在734nm处检测的吸光度为0.700±0.02。将0.8mLABTS溶液与0.2mL样品混合,用95%乙醇作为空白组替代样品,在室温下避光保存6min,在734nm处测量样品的OD值。清除率按下式计算:
式中:X—ABTS自由基清除率,%;A1—样品在734nm下吸光度值;A2—空白组在734nm下吸光度值。
羟自由基清除率:利用Fenton反应得到羟自由基H2O2+Fe2+=·OH+H2O+Fe3+,该反应生成的羟自由基可以与水杨酸反应,生成的2,3-二羟基苯甲酸,其溶液为紫色,并且在510nm有最大吸收。如在以上反应体系中加入抗氧化剂,溶液颜色会变浅。方法如下:将2mLFe(OH)2溶液(6mmol/L)、2mL样品溶液与2mLH2O2溶液混合,反应10min后加入2mL水杨酸溶液(6mmol/L),振荡摇匀静置30min;空白对照组用等量的纯水替代样品溶液,其他条件不改变。在510nm光度下测量吸光度。羟自由基清除率计算公式如下:
式中:X—羟自由基清除率,%;A1—试验组在510nm下吸光度值;A2—对照组在510nm下吸光度值。
总还原力:总还原力参考何艳丽等[21]方法略有修改,取1mL待测样等比例加入0.2mol/L磷酸缓冲盐溶液和2.5mL1%K3Fe(CN)6溶液混合,在50℃恒温水浴20min,取出后加入2.5mL10%三氯乙酸溶液,于8000r/min离心5min,取上清液2.5mL和纯水等比混合后加入0.5mL0.1%FeCl3溶液,混匀反应10min后于700nm处测定吸光度。
1.4 数据处理与统计分析
所有测试数据均用3次独立试验的平均值±标准差表示,使用Excel对数据进行初步整理,利用GraphPad8.0软件进行图表绘制、方差分析和Tukey检验,p<0.05表示差异显著水平。
2 结果与分析
2.1 发酵前后罗布麻叶还原糖含量变化
所求葡萄糖标准曲线为y=0.0002x+0.0457(R²=0.9972),在0~1mg/mL浓度范围内线性关系良好。
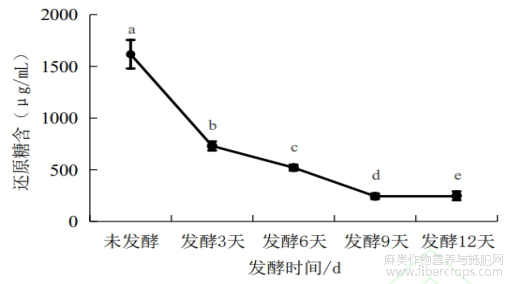
由图1可知,在发酵过程中样品中还原糖含量呈下降趋势,发酵的前3天下降最为显著,发酵第9天到12天,还原糖含量无明显变化,逐渐趋于平稳。发酵初期还原糖含量显著下降,表明黑曲霉快速利用了罗布麻叶中的糖源。随着发酵时间的延续,还原糖含量趋于平稳,说明糖源已基本消耗完毕,黑曲霉的生长进入衰退期。
图1 发酵不同时间样品中还原糖含量变化
注:不同字母代表差异显著(p < 0.05)。
2.2 发酵前后罗布麻叶蛋白含量变化
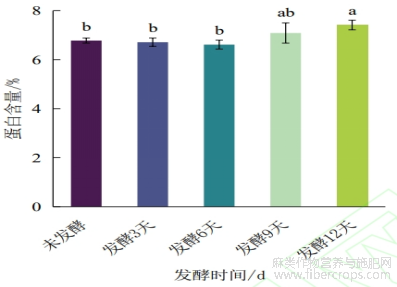
对不同发酵时间罗布麻叶样品中蛋白含量进行测定,结果如图2所示,未发酵罗布麻叶中蛋白含量为6.78%±0.1%,在发酵的前9天样品中蛋白含量无明显变化,发酵12天样品与未发酵及发酵的前6天样品中蛋白质含量有显著性差异。与未发酵相比,发酵12天的样品蛋白含量提高了9.53%。由于未添加额外的氮源,发酵初期蛋白含量无显著变化,可能是由于黑曲霉处于适应阶段,其代谢活动主要集中在生长上,对底物的分解和转化效率较低,导致蛋白含量变化不明显。然而,在发酵后期,黑曲霉逐渐进入稳定生长阶段,代谢活动增强。随着黑曲霉菌体生长和酶的积累,蛋白含量出现了提升,与汤小朋等[22]研究结果相一致。在发酵过程中,微生物利用底物中氮源的同时提高自身的菌体蛋白含量,如黑曲霉菌通过孢子繁殖的方式从膨大的菌丝上产生分生孢子梗[23],并分泌多种蛋白从而导致粗蛋白含量提高。但随着发酵时间延长,当底物不足以供给所需要的能量,微生物代谢活动会逐渐减弱甚至分解自身合成的蛋白质已获取能量,会导致蛋白含量不再增加甚至下降。
图2 发酵不同时间样品中蛋白含量变化
注:不同字母代表差异显著(p < 0.05)。
2.3 发酵前后罗布麻叶氨基酸含量变化
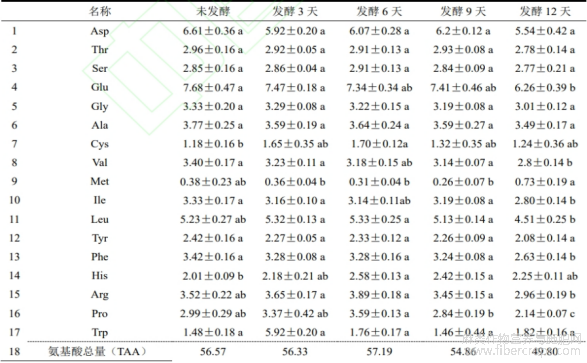
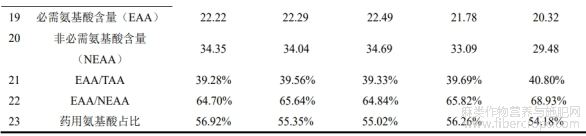
对样品中氨基酸含量进行了测定,结果如表1所示,测得未发酵罗布麻样品中17种氨基酸总量(TAA)为56.57mg/g,必需氨基酸(EAA)含量为22.22mg/g,EAA/TAA占比为39.28%,非必需氨基酸(NEAA)含量为34.35mg/g,NEAA/TAA占比为64.70%,药用氨基酸占比为56.92%。在罗布麻中含有的17种氨基酸中,含量排前3位的分别为Glu、Asp、Leu,占TAA的34.50%;含量最低的3种氨基酸分别为Cys、Met、Trp,仅占TAA的5.37%。
在发酵样品中,与未发酵相比,Asp、Thr、Ser、Gly、Ala、Tyr和Trp7种氨基酸含量无显著变化,Cys和His在发酵第6天显著上升。整体来看,在发酵过程中,发酵的前6天氨基酸含量变化不大,发酵第6天TAA仅比未发酵高0.62mg/g,但发酵至第12天,氨基酸含量大幅度下降,比未发酵下降了6.77mg/g。在发酵过程中,必需氨基酸与总氨基酸含量变化趋势一致,且发酵后EAA/TAA均高于未发酵,发酵第12天EAA/TAA比值为0.408,达到WHO/UN关于理想蛋白质中EAA/TAA比值高于0.4的要求。不同发酵天数罗布麻叶的必需氨基酸含量与非必需氨基酸含量的比值(EAA/NEAA)范围在0.647~0.689,均高于WHO/FAO理想蛋白质标准要求的0.6,且药用氨基酸与总氨基酸比值均超过50%。尽管发酵9天后蛋白含量提高,但氨基酸含量的变化并不显著,蛋白质由氨基酸构成,一般情况下,总氨基酸含量会低于或相当于总蛋白含量。凯氏定氮法仅对样品中粗蛋白含量进行测定,是以样品中氮逸出量,再根据换算系数6.25计算得到,与样品实际值会有一定偏差。测定结果表明,在未发酵样品中氨基酸含量仅为5.66%,而耿伊雯等[7]对甘肃及内蒙古不同产地氨基酸含量进行检测,其中甘肃省民勤县罗布麻总游离氨基酸含量为14.426%,内蒙古杭锦旗罗布麻氨基酸含量仅为7.671%,说明不同产地罗布麻的氨基酸含量差异明显。菅丽君等[24]对新疆罗布麻中氨基酸含量进行测定,结果表明新疆罗布麻氨基酸含量为11.82g/100g,远高于福建产地罗布麻中氨基酸含量,但必需氨基酸含量与氨基酸总量的比值(40.7%)与本研究所得结果(39.28%)相差不大。罗布麻中氨基酸含量因产地有所差异,但其必需氨基酸含量与氨基酸总量的比值相差不大。
表1 黑曲霉发酵前后罗布麻叶样品中氨基酸含量
注:同一行中不同字母代表差异显著(p<0.05)。
2.4 发酵前后罗布麻叶主要酚类物质含量变化
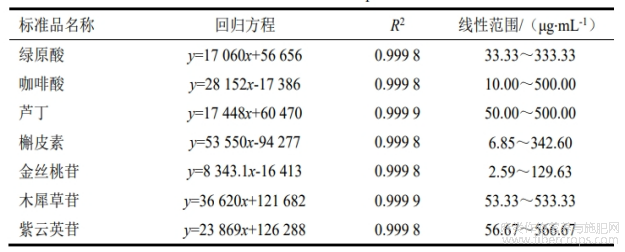
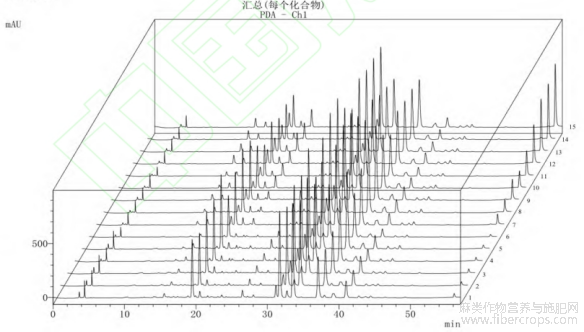
取7种标准品按照1.3.2方法进行测定,标准色谱图如图3所示,利用Excel软件记录峰面积并分别计算出标准曲线,7种物质标准曲线结果见表2。
表2 酚类物质标准曲线
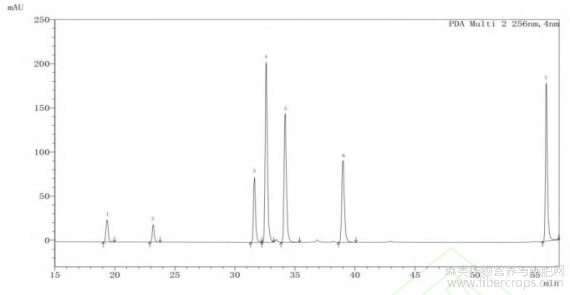
图3 主要酚类物质标准色谱图
注:1—绿原酸;2—咖啡酸;3—芦丁;4—金丝桃苷;5—木犀草苷;6—紫云英苷;7—槲皮素。
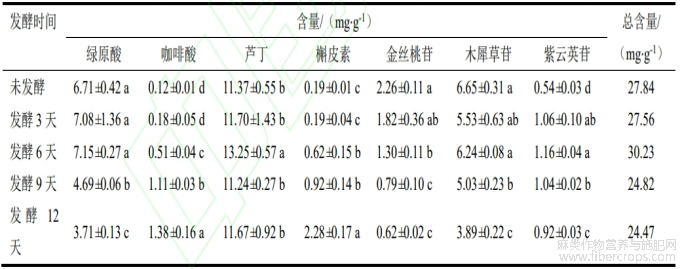
对样品中7种酚类物质进行分析,其色谱图如图4所示,根据标准曲线结果求得样品中各类物质含量如表3所示,经不同发酵时间后的样品中均存在绿原酸、咖啡酸、芦丁和槲皮素等7种成分,其中在未发酵样品中,绿原酸、芦丁、金丝桃苷、木犀草苷几种物质含量较高,分别为6.71±0.42、11.37±0.55、2.26±0.11、6.65±0.31mg/g,在发酵过程中7种物质含量随发酵时间出现显著变化(p<0.05)。在发酵第3天,紫云英苷含量显著上升,在发酵第6天,咖啡酸、芦丁、槲皮素和紫云英苷含量比未发酵样品都有所上升。到发酵第9天及12天,绿原酸、金丝桃苷和木犀草苷含量有所下降。整体来看,绿原酸、芦丁和紫云英苷含量在发酵过程中呈先上升后下降趋势,而咖啡酸和槲皮素含量呈一直上升趋势。对不同发酵时间罗布麻叶中7种物质总含量来说,在发酵第6天含量最高,随着发酵时间延长,总含量有所下降。
表3 黑曲霉发酵不同时期罗布麻叶样品中 7 种酚类物质含量测定结果
注:同列不同小写字母代表差异显著(p<0.05)。
图4 罗布麻样品液相色谱图
注:1~3代表未发酵样品,4~6代表发酵3天样品,7~9代表发酵6天样品,10~12代表发酵9天样品,13~15代表发酵12天样品。
酚类物质是罗布麻中一类主要的活性物质,Espitia-Hernández等[25]研究表明,黑曲霉Aa210发酵高粱提取物可以提高其总黄酮含量,黑曲霉发酵处理可使玉竹黄酮抗氧化能力提高3.59%[26]。本研究利用黑曲霉对罗布麻进行不同发酵时间处理,在发酵第6天提高了其主要酚类物质总含量(p<0.05)。其次,在发酵过程中绿原酸含量和芦丁含量下降,而咖啡酸和槲皮素含量上升,这些变化表明黑曲霉对酚类物质的代谢具有显著影响。研究表明,黑曲霉AKU3302[27]可以水解马黛茶中绿原酸生成奎尼酸和咖啡酸,黑曲霉发酵过程中产生的糖苷酶也可以将芦丁转化为槲皮素[28]。
2.5 发酵前后罗布麻叶抗氧化能力变化
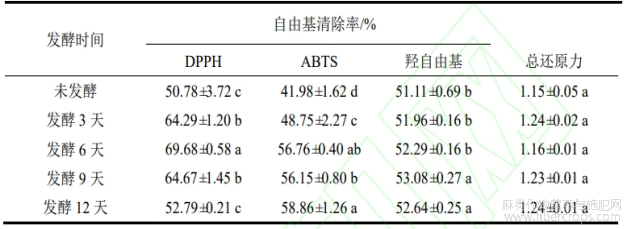
罗布麻叶不同发酵时间提取物抗氧化能力如表4所示,不同发酵时间样品对DPPH自由基的清除能力均随发酵时间先增加后下降。其中发酵第6天时DPPH自由基清除率最高,与未发酵相比,清除率提高了18.90%。ABTS+是一种合成自由基,可用于评估极性和非极性抗氧化物质的清除活性。通过对ABTS+自由基清除率进行测定,结果表明,在发酵第6天及12天ABTS+清除率最高,其中第6天比未发酵样品清除率提高了14.78%。羟自由基清除率在第9天最高,与未发酵相比提升不大,而总还原力在整个发酵过程中均无显著性变化。
表4 黑曲霉发酵不同时期样品中抗氧化能力变化
注:同列中不同小写字母代表差异显著(p<0.05)。
3 讨论与结论
当前,罗布麻制茶主要包括清洗、去碱、晾晒(杀青)、揉捻、炒制等工艺流程,仅有少量研究报道了发酵工艺。现有公开的发明专利中,罗布麻叶发酵采用的菌种包括天然复合菌、假丝酵母[29]、枯草芽孢杆菌、乳酸菌[30]、金花孢子(冠突散囊菌)[31]、酿酒酵母[32]等,同时存在酶处理(如纤维素酶、单宁酶等)的方式。这些方法的主要意图是释放罗布麻生物活性物质、改善罗布麻的口感等。本团队前期对比了米曲菌(Aspergillus. oryzae)、红曲霉菌(Monascus purpureus)和黑曲霉菌发酵效果,发现黑曲霉菌发酵可以显著提高多酚类和黄酮类物质的含量[33]。本研究进一步分析了黑曲霉菌发酵对氨基酸、蛋白质、还原糖、主要酚类物质含量及抗氧化活性的变化特征,为开发高效罗布麻茶发酵工艺提供了科学依据。
本研究利用黑曲霉对罗布麻叶进行发酵,对发酵过程中还原糖、蛋白质、氨基酸和酚类物质的变化进行系统分析,揭示了黑曲霉发酵对罗布麻叶中营养成分和活性物质的显著影响。发酵初期,黑曲霉快速利用糖源,导致还原糖含量下降;发酵后期,黑曲霉的生长和代谢促进了蛋白质和酚类物质含量的提升。氨基酸含量在发酵过程中呈现先稳定后下降的趋势,但必需氨基酸与氨基酸总量的比值显著提高,符合理想蛋白质的标准。发酵改变了罗布麻中主要酚类物质含量,在酚类化合物中,鉴定出7个主要化合物。其中发酵6天对酚类物质释放总量最佳,主要酚类物质含量提高了8.58%,且其抗氧化能力得到有效提升,表明黑曲霉发酵对罗布麻的活性物质代谢具有重要作用。结合绿原酸、芦丁含量呈先上升后下降趋势,而咖啡酸与槲皮素含量呈一直上升趋势,推测一方面可能由于黑曲霉分泌相关碳水化合物水解酶,促进了罗布麻叶中这几种物质的释放,另一方面,随着绿原酸、芦丁的积累,可能绿原酸和芦丁分别被水解为咖啡酸、槲皮素等物质。
本研究主要关注发酵前后罗布麻叶成分的变化及抗氧化活性,为探索黑曲霉发酵对罗布麻资源开发的潜在价值提供数据基础。研究认为罗布麻中的糖苷类物质主要以多糖苷为主,具有抗氧化、抗病毒、抗肿瘤、降血脂等生物活性[34]。本研究主要针对黑曲霉发酵促进还原性糖降解进行了分析,但尚未针对生物活性多糖开展研究。未来还应结合代谢组学、转录组学等技术,深入挖掘更多潜在的功能成分,研究黑曲霉发酵对罗布麻中活性物质的作用机制,为罗布麻资源的开发利用提供理论支持,推动其在保健食品和医药领域的应用。
参考文献
[1] 马浩,吴倩,隗亚军,等.种植密度对不同生育时期罗布白麻生长与叶片饲用品质的影响[J].中国麻业科学,2024,46(04):229-236.
[2] 田苏杰,苏旭中.不同纺纱方式的罗布麻/棉混纺纱性能[J].上海纺织科技,2023,51(10):1-4.
[3] 王丽莎,胡雪敏,青艳,等.罗布麻的主要化学成分与作用及其在纺织领域的应用[J].毛纺科技,2024,52(9):137-143.
[4] 国家药典委员会.中华人民共和国药典-一部:2020年版[M].北京:中国医药科技出版社,2020.
[5] LIU D, WANG S Y, BAO Y L, et al. Extraction, purification and structural characterization of polysaccharides from Apocynum venetum L. roots with anti-inflammatory activity[J]. Process Biochemistry, 2022, 121: 100-112.
[6] 张庆,李国旗,车金凤,等.基于代谢组学的两种罗布麻叶片类黄酮和酚酸成分分析[J].中国野生植物资源,2024,43(1):1-10.
[7] 耿伊雯,宛涛,蔡萍,等.北方野生罗布麻叶片氨基酸种类及含量分析[J].草原与草业,2021,33(2):45-50.
[8] 崔艺燕,李家洲,田志梅,等.康宁木霉固态发酵改善茶渣营养价值[J].草业学报,2022,31(7):96-110.
[9] 刘艳,李瑞君,邢君梅.混菌固态发酵对辣木叶的营养特性的影响[J].轻工科技,2024,40(3):6-11.
[10] ZUO W F, ZHANG T L, XU H F, et al. Effect of fermentation time on nutritional components of red-fleshed apple cider[J]. Food and Bioproducts Processing, 2019, 114: 276-285.
[11] OKAFOR U I, OMEMU A M, OBADINA A O, et al. Nutritional composition and antinutritional properties of maize ogi cofermented with pigeon pea[J]. Food Science & Nutrition, 2018, 6(2): 424-439.
[12] SONG T T, ZHANG Z F, JIN Q L, et al. Nutrient profiles, functional compositions, and antioxidant activities of seven types of grain fermented with Sanghuangporus sanghuang fungus[J]. Journal of Food Science and Technology, 2021, 58(11): 4091-4101.
[13] 顾秋亚,李姝瑶,杨文华,等.富含黄酮苷元沙棘叶发酵茶的制备及其生物活性[J].食品研究与开发,2022,43(24):118-124.
[14] DUAN S W, XU B R, CHENG L F, et al. Bacterial strain for bast fiber crops degumming and its bio-degumming technique[J]. Bioprocess and Biosystems Engineering, 2021, 44(12): 2503-2512.
[15] 张涛,巩继贤,张健飞,等.罗布麻复合微生物脱胶发酵条件的优化[J].印染,2018,44(22):18-23.
[16] DONG L B, MCKINSTRY W J, PAN L, et al. Crystal structure of fungal tannase from Aspergillus niger[J]. Acta Crystallographica Section D Structural Biology, 2021, 77(2): 267-277.
[17] ZHAO J, SHI D C, YANG S, et al. Identification of an intracellular β-glucosidase in Aspergillus niger with transglycosylation activity[J]. Applied Microbiology and Biotechnology, 2020, 104(19):8367-8380.
[18] 李秀清,纪宝玉,裴莉昕,等.槐米的红外快速鉴别与总黄酮?总酚酸?还原糖含量测定[J].中国食品添加剂,2024,35(8):200-207.
[19] BRAND-WILLIAMS W, CUVELIER M E, BERSET C. Use of a free radical method to evaluate antioxidant activity[J]. LWT - Food Science and Technology, 1995, 28(1): 25-30.
[20] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine, 1999, 26(9/10): 1231-1237.
[21] 何艳丽,温锦丽,秦红艳,等.不同软枣猕猴桃资源果实抗氧化活性比较分析[J].食品研究与开发,2024,45(12):35-42.
[22] 汤小朋,赵华,汤加勇,等.黑曲霉固态发酵改善木薯渣品质的研究[J].动物营养学报,2014,26(7):2026-2034.
[23] 陈建荣,陈锦灵.产朊假丝酵母和黑曲霉对银杏叶发酵影响的初步研究[J].当代畜牧,2023(9):17-21.
[24] 菅丽君,远辉,张艳华.红麻与大花白麻两种罗布麻叶中氨基酸的测定及分析[J].中国医药指南,2018,16(29):25-26.
[25] ESPITIA-HERNÁNDEZ P, RUELAS-CHACÓN X, CHÁVEZ-GONZÁLEZ M, et al. Solid-state fermentation of Sorghum by Aspergillus oryzae and Aspergillus niger: effects on tannin content, phenolic profile, and antioxidant activity[J]. Foods, 2022, 11(19): 3121.
[26] 苗润涵,靳萍,夏光辉.发酵处理对玉竹黄酮抗氧化活性的影响研究[J].中国林副特产,2023(2):16-20.
[27] BUTIUK A P, MARTOS M A, HOURS R A. Mycelium-bound chlorogenate hydrolase of Aspergillus niger AKU 3302 as a stable immobilized biocatalyst[J]. Journal of Bioscience and Bioengineering, 2023, 136(2): 94-101.
[28] KAPEŠOVÁ J, PETRÁSKOVÁ L, MARKOŠOVÁ K, et al. Bioproduction of quercetin and rutinose catalyzed by rutinosidase: novel concept of“solid state biocatalysis”[J]. International Journal of Molecular Sciences, 2019, 20(5): 1112.
[29] 李洪金,张齐.一种罗布麻发酵提取物及其制备方法和应用:CN202310495960.9[P].2023-05-05.
[30] 乔金星.用于罗布麻叶提高多糖,黄酮提取量的方法及其发酵罐:CN202210424209.5[P].2022-06-10.
[31] 马涛,杨立娜,朱力杰,等.一种金花发酵罗布麻茶及其制备方法:CN106922905A[P].2017-07-07.
[32] 束成杰,李卓航,马世宏,等.一种罗布麻发酵产物的发酵方法及其在抗炎化妆品中的应用:CN112353733A[P].2021-02-12.
[33] CAO C, LIN D F, ZHOU Y J, et al. Solid-state fermentation of Apocynum venetum L. by Aspergillus niger: Effect on phenolic compounds, antioxidant activities and metabolic syndrome-associated enzymes[J]. Frontiers in Nutrition, 2023, 10: 1125746.
[34] ABUBAKAR A S, AHMAD B, AHMAD N, et al. Physicochemical evaluation, structural characterization, in vitro and in vivo bioactivities of water-soluble polysaccharides from Luobuma (Apocynum L.) tea[J]. Food Chemistry, 2024, 460: 140453.
文章摘自:林登蕃,易著虎,兰小明,周心怡,周映君,朱作华,严理,胡镇修,彭源德,谢纯良.罗布麻叶发酵前后主要营养物质变化及抗氧化活性研究[J/OL].中国麻业科学.https://link.cnki.net/urlid/43.1467.S.20250320.1644.009。